
【题目】工业上制取一氯乙烷(CH3CH2Cl)应采用( )
A. 由乙烯和氯气在一定条件下发生加成反应
B. 由乙烯和氯化氢在一定条件下发生加成反应
C. 由乙烷和氯气在一定条件下发生取代反应
D. 由乙烷和氯气在一定条件下发生加成反应
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2样品,请设计实验测定该样品的纯度。可供选择的装置如图:
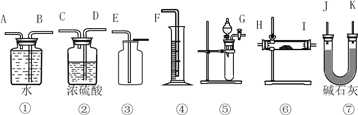
(1)选用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置,选择的仪器组合是____________。
A.①②④⑤ B.①④⑤
C.⑤⑥⑦ D.①③⑤⑦
(2)实验中选用装置的连接顺序是_________________(填各接口的字母,连接胶管省略)。
(3)写出实验中Na2O2发生反应的化学方程式,并用双线桥标注电子转移的方向和数目__________。若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为168mL(标准状况),则Na2O2试样的纯度为_________。
(4)向紫色石蕊试液中加入Na2O2粉末,振荡,正确的叙述是________。
A.最后溶液变蓝 B.溶液先变蓝后褪色
C.溶液仍为紫色 D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关判断的依据正确的是( )
A.电解质:水溶液是否导电
B.原子晶体:构成晶体的微粒是否是原子
C.共价分子:分子中原子间是否全部是共价键
D.化学平衡状态:平衡体系中各组分的物质的量浓度是否相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A﹣ , 在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,已知25℃时,HA、H2CO3的电力平衡常数分别为K=6.25×10﹣5、K1=4.3×10﹣7 , 下列说法正确的是(不考虑饮料中其他成分)( )
A.提高CO2充气压力,饮料中c(A﹣)不变
B.当pH为5.0时,饮料中 ![]() =0.16
=0.16
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A﹣>HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )

A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO![]() 物质的量的变化
物质的量的变化
【答案】B
【解析】假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
点睛:本题考查镁铝重要化合物、离子反应、化学计算等,根据相互滴加过程离子物质的量的变化确定图象表示向AlCl3溶液中滴加NaOH溶液是解题的关键。假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
【题型】单选题
【结束】
17
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
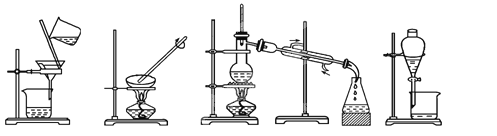
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图1所示. 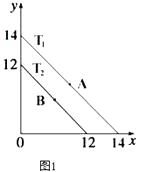
①若从A点到B点,可采取的措施为
②T2℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH﹣)将(填“增大”、“减小”、“不变”).
③已知:T1℃时,醋酸的电离常数为 1.8×10﹣5 , 则 T1℃时,在 0.5molL﹣1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍 .
④T2℃时,将某溶液(此溶液满足 lg[ ![]() ]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
(2)体积均为1mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图2所示: 
①m的取值为 .
②a点酸的浓度b点酸的浓度(填“>”、“<”、“=”).
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是 .
A.c(A﹣) B.n(H+)n(OH﹣) C. ![]() D.
D. ![]()
(3)已知:25℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10﹣10 , K1=4.3×10﹣7、K2=5.6×10﹣11 , 向NaCN溶液中通入少量CO2 , 所发生反应的离子方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对标准状况下的四种气体的关系从小到大表示不正确的是( )
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3 .
A.质量:④<①<③<②
B.密度:①<④<③<②
C.体积:④<①<②<③
D.氢原子数:②<④<③<①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com