
【题目】下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )

A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO![]() 物质的量的变化
物质的量的变化
【答案】B
【解析】假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
点睛:本题考查镁铝重要化合物、离子反应、化学计算等,根据相互滴加过程离子物质的量的变化确定图象表示向AlCl3溶液中滴加NaOH溶液是解题的关键。假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
【题型】单选题
【结束】
17
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
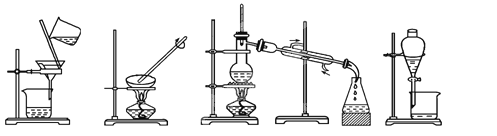
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
【答案】 ③ ② ① ④ AlCl3 NaOH 0.5
【解析】(1)水易挥发,海水中提取水可用蒸馏的方法,答案选③;从 KCl溶液中获取KCl晶体,可用蒸发的方法,答案选②;CaCO3不溶于水,分离CaCO3和水,可用过滤的方法,答案选①;植物油和水互不相溶,分离植物油和水,可用分液的方法,答案选④;
(2)氯化铝滴入NaOH溶液中,开始氢氧化钠过量,发生反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,乙为NaOH溶液,由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为![]() =0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
=0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。


科目:高中化学 来源: 题型:
【题目】已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
O2(g)=8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
B.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=﹣5518 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=﹣5518 kJmol﹣1
C.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJmol﹣1
D.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=﹣48.40 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=﹣48.40 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成DB2、DB3两种分子,DB2具有漂白性.
A | B | |
C | D |
回答下列问题:
(1)A位于元素周期表周期,族,其氢化物的分子式是 .
(2)下列叙述中,正确的是(填字母).
a.稳定性:A的氢化物>C的氢化物 b.还原性:B2﹣>D2﹣
c.酸性:H4CO4>H2DO4 d.最高化合价值:D=B>A>C
(3)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2 . 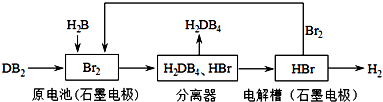
①原电池中DB2参与反应的电极为 , 写出电极反应式;若有5mol DB2参加反应(假若反应物无损耗),则生成标准状况下L H2 .
②为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 , 证明分离效果较好.
③将该工艺流程用总反应的化学方程式表示为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有碳酸钠和碳酸氢钠的固体混合物,先取m g固体样品进行加热,完全分解产生CO2气体112 mL;另取m g固体样品溶于水,加入足量的盐酸时产生CO2 448 mL(气体体积均为标准状况下测定)。
(1)求m g混合物中碳酸氢钠与碳酸钠的物质的量各是多少?_________
(2)若产生448 mL CO2时,消耗盐酸的体积为300mL,则该盐酸的物质的量浓度是多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取一氯乙烷(CH3CH2Cl)应采用( )
A. 由乙烯和氯气在一定条件下发生加成反应
B. 由乙烯和氯化氢在一定条件下发生加成反应
C. 由乙烷和氯气在一定条件下发生取代反应
D. 由乙烷和氯气在一定条件下发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关共价键的说法正确的是( )
A.分子晶体中共价键越强,熔沸点越高
B.只含共价键的物质,一定是共价化合物
C.两种元素组成的分子中一定只含有极性共价键
D.分子晶体中,可能不存在共价键,但一定存在分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,雾霾的形成与汽车排放的 NOx等有毒气体有关.
(1)可以通过活性炭处理汽车尾气,原理为:C(s)+2NO(g)N2(g)+CO2(g)△H<0.
①下列情况能说明该反应达到平衡状态的是
A.2ν正(NO)=ν逆(CO2)
B.在恒温、恒容的容器中,混合气体的压强保持不变
C.在绝热、恒容的容器中,反应的平衡常数不再变化
D.在恒温、恒压的容器中,混合气体的密度保持不变
②在恒温、恒容条件下,加入2mol C(s)和2mol NO(g)达平衡后,再在绝热、恒容条件下,加入1mol NO重新达平衡后,N2的百分含量将(填“增大”、“减小”、“不变”).
(2)臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g)N2O5(g)+O2(g).
若在容积为10L的密闭容器中进行该反应,起始时充入0.4molNO2、0.2mol O3 , 反应在不同条件下进行,反应体系总压强随时间的变化如图1所示.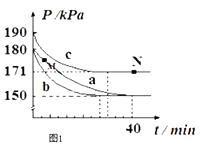
①实验a从开始至平衡时的反应速率v(O3)=;实验c中NO2的平衡转化率为 .
②与实验a相比,其他两组改变的实验条件分别是:b , c .
③M点的逆反应速率 v(逆)N点的正反应速率v(正) (填“>”、“<”或“=”).
④若在N点时,维持温度和压强不变,t1时再加入0.4molNO2、0.2mol O3 , 请在图中画出逆反应速率在t1后随时间t的变化曲线图2 . 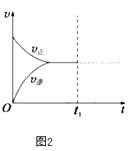
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水中的电离方程式书写正确的是
A. Al2(SO4)3===2Al3++3SO![]() B. NaHCO3===Na++H++CO32-
B. NaHCO3===Na++H++CO32-
C. CH3COOH===CH3COO- + H+ D. KClO3===K++Cl-+3O2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com