
����Ŀ��������Ԫ��A��B��C��D�����ڱ��е�λ����ͼ��ʾ��B��D����������֮��Ϊ12�����߿��γ�DB2��DB3���ַ��ӣ�DB2����Ư���ԣ�
A | B | |
C | D |
�ش��������⣺
��1��Aλ��Ԫ�����ڱ����ڣ��壬���⻯��ķ���ʽ�� ��
��2�����������У���ȷ����������ĸ����
a���ȶ��ԣ�A���⻯�C���⻯�� b����ԭ�ԣ�B2����D2��
c�����ԣ�H4CO4��H2DO4 d������ϼ�ֵ��D=B��A��C
��3��DB2ͨ�����й������̿��ƻ���ҵԭ��H2DB4�������ԴH2 �� 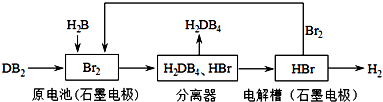
��ԭ�����DB2���뷴Ӧ�ĵ缫Ϊ �� д���缫��Ӧʽ������5mol DB2�μӷ�Ӧ��������Ӧ������ģ��������ɱ�״����L H2 ��
��Ϊ����������ķ���Ч����ȡ������H2DB4��Һ���Թܣ���������μ���AgNO3��Һ����ַ�Ӧ�����۲쵽 �� ֤������Ч���Ϻã�
�۽��ù����������ܷ�Ӧ�Ļ�ѧ����ʽ��ʾΪ��
���𰸡�
��1������VA��NH3
��2��a
��3��������SO2+2H2O��2e��=4H++SO42����112������ɫ�����������������ɰ�ɫ������SO2+2H2O=H2SO4+H2
���������⣺�ɶ�����Ԫ��A��B��C��D�����ڱ��е�λ�ÿ�֪��A��B���ڵڶ����ڣ�C��D���ڵ������ڣ�B��Dͬ�����壬B��D����������֮��Ϊ12��������������Ϊ6����BΪOԪ�أ�DΪSԪ�أ����߿����γ�SO2��SO3���ַ��ӣ���SO2����Ư���ԣ���λ�ù�ϵ��֪��AΪNԪ�أ�CΪSiԪ�أ���1��AΪNԪ�أ����ڵڶ�����VA�壬���⻯��ΪNH3 �� ���Դ��ǣ�����VA��NH3����2��a���ǽ�����N��Si�����⻯���ȶ���NH3��SiH4 �� ��a��ȷ��b���ǽ�����O��S���ǽ�����Խǿ�������ӵĻ�ԭ��Խ�����ʻ�ԭ��O2����S2�� �� ��b����
C���ǽ�����S��Si�������ԣ�H4SiO4��H2SO4 �� ��c����
d����Ԫ��һ��û�������ϼۣ���d����
���Դ��ǣ�a����3���ɹ�������ͼ��֪��ԭ���ԭ��ΪSO2+Br2+2H2O=H2SO4+2HBr����������ᣬ�ٵ�⣺2HBr ![]() H2��+Br2 �� ������������õ�����ѭ�����ã�
H2��+Br2 �� ������������õ�����ѭ�����ã�
����ԭ����У���������������Ӧ��SO2�ڸ����ŵ�����H2SO4 �� �缫��ӦʽΪSO2+2H2O��2e��=4H++SO42�� �� ����SO2+Br2+2H2O=H2SO4+2HBr��2HBr ![]() H2��+Br2�ɵù�ϵʽ��SO2��H2 �� ����5mol SO2�μӷ�Ӧ��������Ӧ������ģ��������ɱ�״����H2���Ϊ5mol��22.4L/mol=112L��
H2��+Br2�ɵù�ϵʽ��SO2��H2 �� ����5mol SO2�μӷ�Ӧ��������Ӧ������ģ��������ɱ�״����H2���Ϊ5mol��22.4L/mol=112L��
���Դ��ǣ�������SO2+2H2O��2e��=4H++SO42����112��
�ڷ�����H2SO4��Һ���Թܣ���������μ���AgNO3��Һ����ַ�Ӧ�����۲쵽����ɫ�����������������ɰ�ɫ������˵������Ч���Ϻã����Դ��ǣ�����ɫ�����������������ɰ�ɫ������
��ԭ����е���ܷ�ӦΪSO2+Br2+2H2O=H2SO4+2HBr���������ܷ�ӦΪ2HBr=H2+Br2 �� �ʸù����������ܷ�Ӧ�Ļ�ѧ����ʽ��ʾΪ��SO2+2H2O=H2SO4+H2 ��
���Դ��ǣ�SO2+2H2O=H2SO4+H2 ��


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����۵��ɵ͵���������ȷ����
A.O2�� I2�� HgB.CO2�� KCl�� SiO2
C.Na �� K �� RbD.SiC�� NaCl �� SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A����Ҫ���л�����ԭ�ϣ���A�����·�Ӧ���Ʊ�һ���л�������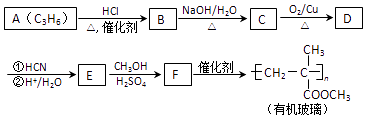
��֪������Ϣ��
�ٺ˴Ź������ױ���Dֻ��һ�ֻ�ѧ�������⣻
���ʻ�������ɷ������·�Ӧ�� 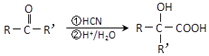 ��ע��R�������������Ҳ������Hԭ�ӣ�
��ע��R�������������Ҳ������Hԭ�ӣ�
��E�ڼ״�������������£�������������ˮ��Ӧ����F��
�ش��������⣺
��1��A�Ľṹ��ʽΪ �� A����B�ķ�Ӧ����Ϊ ��
��2��B����C�Ļ�ѧ����ʽΪ ��
��3��D�Ľṹ��ʽΪ �� �������������ԭ�ӹ�ƽ�森
��4��E�Ļ�ѧ����Ϊ ��
��5��F��ͬ���칹������ͬʱ�������������Ĺ����֣����������칹����
�����뱥��NaHCO3��Һ��Ӧ�������� ����ʹBr2�����Ȼ�̼��Һ��ɫ
���к˴Ź���������ʾΪ4��壬�ҷ������Ϊ3�s2�s2�s1������д������һ�ֵĽṹ��ʽ����
��6�������ᣨ 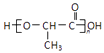 ����һ������ɽ�����ϣ��ο�������Ϣ������Ҵ��Ʊ�������ĺϳ�·�� �� ��ʾ������Ӧ����X
����һ������ɽ�����ϣ��ο�������Ϣ������Ҵ��Ʊ�������ĺϳ�·�� �� ��ʾ������Ӧ����X ![]() Y
Y ![]() Z ����
Z ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Իش����и��⣺ 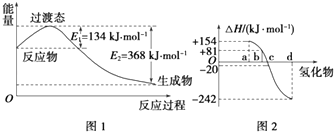
��1����ͼ1��ʾ��NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��
��2����ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йأ�
����֪��H2��g��+Cl2��g���T2HCl��g����H=��185kJmol��1
����գ�
���ۼ� | H��H | Cl��Cl | H��Cl |
����/��kJmol��1�� | 436 | 247 |
��ͼ2�б�ʾ����Ԫ���������������������⻯��ʱ���ʱ����ݣ������ʱ����ݿ�ȷ��a��b��c��d�ֱ��������Ԫ�أ���д��������������ѧ��״̬�£������ֽⷴӦ���Ȼ�ѧ����ʽ�� ��
��3����֪��Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H=��25kJmol��1��
3Fe2O3��s��+CO��g���T2Fe3O4��s��+CO2��g����H=��47kJmol��1��
Fe3O4��s��+CO��g���T3FeO��s��+CO2��g����H=+19kJmol��1��
��д��CO��ԭFeO���Ȼ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��������Na2O���ʵ�Na2O2��Ʒ�������ʵ��ⶨ����Ʒ�Ĵ��ȡ��ɹ�ѡ���װ����ͼ��
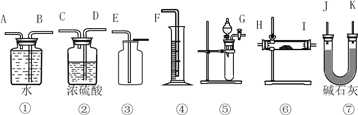
��1��ѡ������װ�ÿ�����װһ����IJⶨ����������Ʒ���ȵ�ʵ��װ�ã�ѡ������������____________��
A���٢ڢܢ� B���٢ܢ�
C���ݢޢ� D���٢ۢݢ�
��2��ʵ����ѡ��װ�õ�����˳����_________________������ӿڵ���ĸ�����ӽ���ʡ�ԣ���
��3��д��ʵ����Na2O2������Ӧ�Ļ�ѧ����ʽ,����˫���ű�ע����ת�Ƶķ������Ŀ__________������ʼʱ�����Ʒ������Ϊ2.0 g����Ӧ���������������Ϊ168mL(��״��)����Na2O2�����Ĵ���Ϊ_________��
��4������ɫʯ����Һ�м���Na2O2��ĩ��������ȷ��������________��
A�������Һ���� B����Һ�ȱ�������ɫ
C����Һ��Ϊ��ɫ �� D����ΪNa2O2��ʯ���������ԭ��Ӧ�������ݲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���������ͬ�� Ba��OH��2��Һ�У��ֱ�������ʵ���Ũ����ȵ�H2SO4��NaHSO4��Һ���䵼�������������Һ����仯��������ͼ��ʾ�����з�������ȷ���ǣ� �� 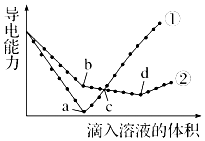
A.�ٴ����μ�H2SO4��Һ�ı仯����
B.b�㣬ˮ���������c��H+����10��7mol/L
C.c�㣬����Һ�к�����ͬ���� OH��
D.a��d�����Ӧ����Һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��жϵ�������ȷ���ǣ�������
A.����ʣ�ˮ��Һ�Ƿ�
B.ԭ�Ӿ��壺���ɾ�������Ƿ���ԭ��
C.���۷��ӣ�������ԭ�Ӽ��Ƿ�ȫ���ǹ��ۼ�
D.��ѧƽ��״̬��ƽ����ϵ�и���ֵ����ʵ���Ũ���Ƿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾAlCl3��Һ��NaOH��Һ��μӻ�ϣ���ͼ���жϴ�����ǣ� ��

A. ���߱�ʾAl3+���ʵ����ı仯
B. x��ʾAlCl3�����ʵ���
C. ���߱�ʾAl(OH)3���ʵ����ı仯
D. ���߱�ʾAlO![]() ���ʵ����ı仯
���ʵ����ı仯
���𰸡�B
���������ٶ�����1molAlCl3��Һ�еμ�NaOH��Һ�����ȷ�����ӦAl3++3OH-=Al(OH)3����Al3+��ȫ����������3molOH-������1molAl(OH)3��Ȼ������ӦAl(OH)3+OH-=AlO2-+2H2O��������ȫ�ܽ�����1molOH-������1molAlO2-��ǰ�����������ĵ�OH-Ϊ3��1���ٶ�����4molNaOH��Һ�еμ�AlCl3��Һ�����ȷ�����ӦAl3++4OH-=AlO2-+2H2O��OH-��ȫ��Ӧ����1molAl3+������1molAlO2-��Ȼ������ӦAl3++3AlO2-+6H2O=4Al(OH)3����AlO2-��ȫ��Ӧ������![]() molAl3+������
molAl3+������![]() molAl(OH)3����ǰ�����������ĵ�Al3+Ϊ1mol��
molAl(OH)3����ǰ�����������ĵ�Al3+Ϊ1mol�� ![]() mol=3��1����ͼ���֪���٢ڱ�ʾ�����ܱۢ�ʾ�����ʵ�����ϵΪ1��1��֪����ͼ��ʾ��AlCl3��Һ�еμ�NaOH��Һ��A��������������֪�����ȷ�����ӦAl3++3OH-=Al(OH)3������Һ�����������ʵ������٣����߱�ʾAl3+�����ʵ����ı仯��ѡ��A��ȷ��B��������������֪��x��ʾNaOH��Һ��ѡ��B����C��������������֪���淴Ӧ����Al(OH)3���ʵ��������������С���ʢڢ��߱�ʾAl(OH)3�����ʵ����ı仯��ѡ��C��ȷ��D��������������֪��Al(OH)3�ܽ�ʱ��AlO2-�����ʵ��������߱�ʾAlO2-�����ʵ����ı仯��ѡ��D��ȷ����ѡB��
mol=3��1����ͼ���֪���٢ڱ�ʾ�����ܱۢ�ʾ�����ʵ�����ϵΪ1��1��֪����ͼ��ʾ��AlCl3��Һ�еμ�NaOH��Һ��A��������������֪�����ȷ�����ӦAl3++3OH-=Al(OH)3������Һ�����������ʵ������٣����߱�ʾAl3+�����ʵ����ı仯��ѡ��A��ȷ��B��������������֪��x��ʾNaOH��Һ��ѡ��B����C��������������֪���淴Ӧ����Al(OH)3���ʵ��������������С���ʢڢ��߱�ʾAl(OH)3�����ʵ����ı仯��ѡ��C��ȷ��D��������������֪��Al(OH)3�ܽ�ʱ��AlO2-�����ʵ��������߱�ʾAlO2-�����ʵ����ı仯��ѡ��D��ȷ����ѡB��
�㾦�����⿼��þ����Ҫ��������ӷ�Ӧ����ѧ����ȣ�������μӹ����������ʵ����ı仯ȷ��ͼ���ʾ��AlCl3��Һ�еμ�NaOH��Һ�ǽ���Ĺؼ����ٶ�����1molAlCl3��Һ�еμ�NaOH��Һ�����ȷ�����ӦAl3++3OH-=Al(OH)3����Al3+��ȫ����������3molOH-������1molAl(OH)3��Ȼ������ӦAl(OH)3+OH-=AlO2-+2H2O��������ȫ�ܽ�����1molOH-������1molAlO2-��ǰ�����������ĵ�OH-Ϊ3��1���ٶ�����4molNaOH��Һ�еμ�AlCl3��Һ�����ȷ�����ӦAl3++4OH-=AlO2-+2H2O��OH-��ȫ��Ӧ����1molAl3+������1molAlO2-��Ȼ������ӦAl3++3AlO2-+6H2O=4Al(OH)3����AlO2-��ȫ��Ӧ������![]() molAl3+������
molAl3+������![]() molAl(OH)3����ǰ�����������ĵ�Al3+Ϊ1mol��
molAl(OH)3����ǰ�����������ĵ�Al3+Ϊ1mol�� ![]() mol=3��1����ͼ���֪���٢ڱ�ʾ�����ܱۢ�ʾ�����ʵ�����ϵΪ1��1��֪����ͼ��ʾ��AlCl3��Һ�еμ�NaOH��Һ���ݴ˽��ѡ������
mol=3��1����ͼ���֪���٢ڱ�ʾ�����ܱۢ�ʾ�����ʵ�����ϵΪ1��1��֪����ͼ��ʾ��AlCl3��Һ�еμ�NaOH��Һ���ݴ˽��ѡ������
�����͡���ѡ��
��������
17
����Ŀ����1������ʵ����Ҫ������װ���н��У�������ţ�ÿ��װ�ý�ʹ��һ�Σ�
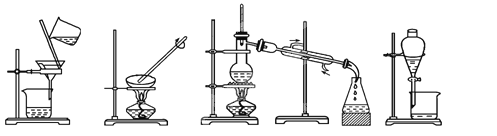
�� �� �� ��
�Ӻ�ˮ����ȡˮ��____________����KCl��Һ�л�ȡKCl���壺____________��
����CaCO3��ˮ��____________������ֲ���ͺ�ˮ��____________��
��2�����мס�����ƿ��ɫ��Һ����֪���ǿ���ΪAlCl3��Һ��NaOH��Һ���ֱַ�һ������ļס�������Һ��ϣ�����������±���ʾ����ش�
ʵ��� | ʵ��� | ʵ��� | |
ȡ��ƿ��Һ���� | 400 mL | 120 mL | 120 mL |
ȡ��ƿ��Һ���� | 120 mL | 440 mL | 400 mL |
���ɳ������� | 1.56 g | 1.56 g | 3.12 g |
�ټ�ƿ��ҺΪ________��Һ��
����ƿ��ҺΪ________��Һ�������ʵ���Ũ��Ϊ________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ⱦ�ѳ�Ϊ����������ٵ��ش���в�����ж�Ӧ��ϵ����ȷ����
�������� | ��Ҫ��Ⱦ�� | �������� | ��Ҫ��Ⱦ�� | ||
A | ���� | �������� | C | ��ɫ��Ⱦ | �������� |
B | ����ЧӦ | ������̼ | D | �⻯ѧ���� | �������� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com