
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃: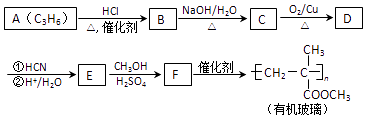
已知以下信息:
①核磁共振氢谱表明D只有一种化学环境的氢;
②羰基化合物可发生以下反应: 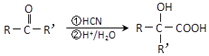 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)
③E在甲醇、硫酸的作用下,发生酯化、脱水反应生成F.
回答下列问题:
(1)A的结构简式为 , A生成B的反应类型为 .
(2)B生成C的化学方程式为 .
(3)D的结构简式为 , 分子中最多有个原子共平面.
(4)E的化学名称为 .
(5)F的同分异构体中能同时满足下列条件的共有种(不含立体异构);
①能与饱和NaHCO3溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
其中核磁共振氢谱显示为4组峰,且峰面积比为3﹕2﹕2﹕1的是(写出其中一种的结构简式).
(6)聚乳酸( 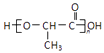 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 . (示例:反应条件X
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 . (示例:反应条件X ![]() Y
Y ![]() Z …)
Z …)
【答案】
(1)CH2=CHCH3;加成反应
(2)CH3CHClCH3+NaOH ![]() CH3CH(OH)CH3+NaCl
CH3CH(OH)CH3+NaCl
(3)CH3COCH3;4
(4)2﹣甲基2﹣丙烯酸
(5)9;CH2=C(CH3)CH2COOH
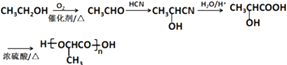
(6)
【解析】解:F发生加聚反应生成有机玻璃,则F结构简式为CH2=C(CH3)COOCH3 , E和甲醇发生酯化反应生成F,E结构简式为CH2=C(CH3)COOH;
A是链烃,根据A分子式知,A结构简式为CH2=CHCH3 , A和HCl发生加成反应生成B,B发生取代反应生成C,C发生催化氧化反应生成D,核磁共振氢谱表明D只有一种化学环境的氢,则D结构简式为CH3COCH3 , C结构简式为CH3CH(OH)CH3 , B结构简式为CH3CHClCH3 , D发生加成反应然后酸化得到E,(1)A的结构简式为CH2=CHCH3 , A生成B的反应类型为加成反应,
所以答案是:CH2=CHCH3;加成反应;(2)C结构简式为CH3CH(OH)CH3 , B结构简式为CH3CHClCH3 , B生成C的化学方程式为CH3CHClCH3+NaOH ![]() CH3CH(OH)CH3+NaCl,
CH3CH(OH)CH3+NaCl,
所以答案是:CH3CHClCH3+NaOH ![]() CH3CH(OH)CH3+NaCl;(3)D的结构简式为CH3COCH3 , 分子中最多有4个原子共平面,
CH3CH(OH)CH3+NaCl;(3)D的结构简式为CH3COCH3 , 分子中最多有4个原子共平面,
所以答案是:CH3COCH3;4;(4)E结构简式为CH2=C(CH3)COOH,E的化学名称为2﹣甲基2﹣丙烯酸,
所以答案是:2﹣甲基2﹣丙烯酸;(5)F结构简式为CH2=C(CH3)COOCH3 , F的同分异构体中能同时满足下列条件,
①能与饱和NaHCO3溶液反应产生气体,说明含有羧基;
②能使Br2的四氯化碳溶液褪色说明含有碳碳双键,
如果主链上含5个碳原子的结构有5种;
如果主链上含有4个碳原子,符合条件的结构有4种;
则符合条件的有9种,
其中核磁共振氢谱显示为4组峰,且峰面积比为3﹕2﹕2﹕1的是CH2=C(CH3)CH2COOH,
所以答案是:9;CH2=C(CH3)CH2COOH;(6)由乙醇为起始原料制备聚乳酸 ![]() ,乙醇先氧化生成乙醛,乙醛与HCN发生加成反应,然后水解生成乳酸,发生加聚反应可生成聚乳酸,流程为
,乙醇先氧化生成乙醛,乙醛与HCN发生加成反应,然后水解生成乳酸,发生加聚反应可生成聚乳酸,流程为 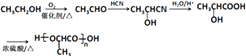 ,
,
所以答案是: 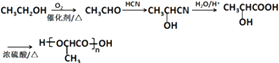 .
.


科目:高中化学 来源: 题型:
【题目】一定条件下反应A(g)+B(g)C(g)△H<0达到平衡后,据下列图象判断:
达到新的平衡对应的图象 | 平衡移动方向 | |
(i)使用催化剂 | ||
(ii)升温 | ||
(iii)降压 | ||
(iv)增加A的量 | ||
(v)减少C的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
O2(g)=8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
B.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=﹣5518 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=﹣5518 kJmol﹣1
C.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJmol﹣1
D.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=﹣48.40 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=﹣48.40 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol·L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是( )
A. 11.2g B. 5.6g
C. 2.8g D. 1.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2 , 转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2 , 转移的电子数目为3.75NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是 ( )
A. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
D. 萃取操作时,在选择萃取剂时,要求萃取剂和原溶剂不互溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成DB2、DB3两种分子,DB2具有漂白性.
A | B | |
C | D |
回答下列问题:
(1)A位于元素周期表周期,族,其氢化物的分子式是 .
(2)下列叙述中,正确的是(填字母).
a.稳定性:A的氢化物>C的氢化物 b.还原性:B2﹣>D2﹣
c.酸性:H4CO4>H2DO4 d.最高化合价值:D=B>A>C
(3)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2 . 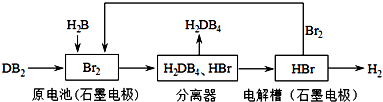
①原电池中DB2参与反应的电极为 , 写出电极反应式;若有5mol DB2参加反应(假若反应物无损耗),则生成标准状况下L H2 .
②为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 , 证明分离效果较好.
③将该工艺流程用总反应的化学方程式表示为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com