
【题目】实现下列变化,需克服相同类型作用力的是( )
A.石墨和氯化钠分别受热熔化
B.冰的融化和水的分解
C.NaCl和HCl溶于水
D.干冰和碘的升华
科目:高中化学 来源: 题型:
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃: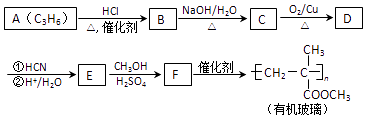
已知以下信息:
①核磁共振氢谱表明D只有一种化学环境的氢;
②羰基化合物可发生以下反应: 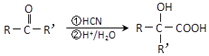 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)
③E在甲醇、硫酸的作用下,发生酯化、脱水反应生成F.
回答下列问题:
(1)A的结构简式为 , A生成B的反应类型为 .
(2)B生成C的化学方程式为 .
(3)D的结构简式为 , 分子中最多有个原子共平面.
(4)E的化学名称为 .
(5)F的同分异构体中能同时满足下列条件的共有种(不含立体异构);
①能与饱和NaHCO3溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
其中核磁共振氢谱显示为4组峰,且峰面积比为3﹕2﹕2﹕1的是(写出其中一种的结构简式).
(6)聚乳酸( 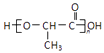 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 . (示例:反应条件X
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 . (示例:反应条件X ![]() Y
Y ![]() Z …)
Z …)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关判断的依据正确的是( )
A.电解质:水溶液是否导电
B.原子晶体:构成晶体的微粒是否是原子
C.共价分子:分子中原子间是否全部是共价键
D.化学平衡状态:平衡体系中各组分的物质的量浓度是否相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )

A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO![]() 物质的量的变化
物质的量的变化
【答案】B
【解析】假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
点睛:本题考查镁铝重要化合物、离子反应、化学计算等,根据相互滴加过程离子物质的量的变化确定图象表示向AlCl3溶液中滴加NaOH溶液是解题的关键。假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
【题型】单选题
【结束】
17
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
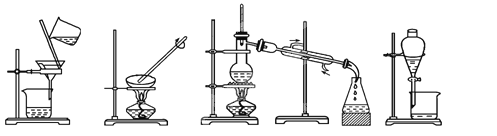
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图1所示. 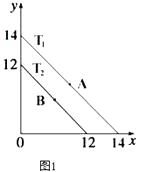
①若从A点到B点,可采取的措施为
②T2℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH﹣)将(填“增大”、“减小”、“不变”).
③已知:T1℃时,醋酸的电离常数为 1.8×10﹣5 , 则 T1℃时,在 0.5molL﹣1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍 .
④T2℃时,将某溶液(此溶液满足 lg[ ![]() ]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
(2)体积均为1mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图2所示: 
①m的取值为 .
②a点酸的浓度b点酸的浓度(填“>”、“<”、“=”).
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是 .
A.c(A﹣) B.n(H+)n(OH﹣) C. ![]() D.
D. ![]()
(3)已知:25℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10﹣10 , K1=4.3×10﹣7、K2=5.6×10﹣11 , 向NaCN溶液中通入少量CO2 , 所发生反应的离子方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大威胁,下列对应关系不正确的是
环境问题 | 主要污染物 | 环境问题 | 主要污染物 | ||
A | 酸雨 | 二氧化硫 | C | 白色污染 | 二氧化硅 |
B | 温室效应 | 二氧化碳 | D | 光化学烟雾 | 二氧化氮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( ) 
A.该反应的△H=+91 kJmol﹣1
B.加入催化剂,该反应的△H变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则△H减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com