
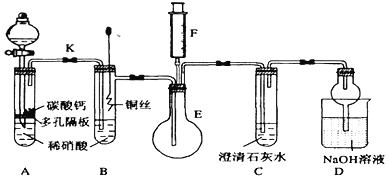
����Ŀ��ijУ����С��Ϊ��̽��ͭ��ϡ���ᷴӦ������������Ҫ��NO�����������ʵ�飬װ����ͼ��ʾ(����װ�ú̶�װ�þ�����ȥ)��ͼ��KΪֹˮ��(���ڹر�״̬)��F��һ����ҳ���������ע������
��ش��й����⣺
��1�����װ��A��Ŀ����___________________��Ϊ�ﵽ��Ŀ�ģ�Ӧ��β�����_____________��
��2������1���еIJ�����װ��B��ͭ˿����ϡ���ᣬ����֮���۲쵽װ��B�е�������________�� B�з�Ӧ�����ӷ���ʽΪ��________________________��װ��B�к��ŵ�_____________________________��
��3��װ��E��F��������________________��Ϊʵ�ִ����ã������������_____________________________��
��4��Dװ����NaOH��Һ������_____________________________��
���𰸡��������ɵ�CO2������װ���ڵĿ����ž������ų���Cu��ϡHNO3��Ӧ�������۲�ĸ��Ŵ�K����װ��C�в�����ɫ����ʱ���ر�Kͭ˿����������ݣ�ϡ����Һ������Ϊ��ɫ����Һ��Ϊ��ɫ3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��ʱ���Ʒ�Ӧ�Ľ�����ֹͣ��֤��ɫ����ΪNO��ע����F�еĿ�������E������NO��NO2��β������ֹ��Ⱦ����
��������
��ʵ��װ�ü����̿�֪��A�з���������̼��Ƶķ�Ӧ���ɶ�����̼������ƿ���п����������ɵ�NO����������Ӧ���ɶ�������������Aװ�÷�Ӧ���ɵĶ�����̼����Ͼ�װ���еĿ��������һ�������������ĸ��ţ�Ϊ�ﵽ��Ŀ�ģ�B�з���Cu������ķ�Ӧ����NO������ͭ��E���ռ�����ɫ����NO������F����������ɼ���NO�����ɣ�Cװ�ÿɼ��������̼����B��Eװ�ã�Dװ��Ϊβ������װ�ã����յ����������ֹ��Ⱦ������
��1������ƿ���п����������ɵ�NO����������Ӧ���ɶ�������������Aװ�÷�Ӧ���ɵĶ�����̼����Ͼ�װ���еĿ��������һ�������������ĸ��ţ�Ϊ�ﵽ��Ŀ�ģ�Ӧ���еIJ����ǹ۲쵽C�б���ǣ��ر�K���ƶ�ͭ˿������Ӵ�����2����ͭ��ϡ���ᷴӦ��������ͭ��NO��ˮ�������ӷ�ӦΪ3Cu+2NO3��+8H���T3Cu2��+2NO��+4H2O���۲쵽����ð������Һ��Ϊ��ɫ�� װ��B�к��ŵ���ʱ���Ʒ�Ӧ�Ľ�����ֹͣ����3����F�еĿ�������E�У�����2NO+O2=2NO2��E����ɫ�����Ϊ����ɫ��֤��NO���ڣ���װ��E��F����������֤NO��������װ��E��F�������ǣ���֤NO�����ɣ�Ϊʵ�ִ����ã�����������ǣ���F�еĿ�������E�У���4��NO��NO2���ж�������Ⱦ�����������������ܱ�NaOH��Һ���գ���װ��D������Ϊ���ն���ĵ��������ֹ��Ⱦ������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
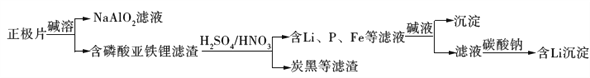
����Ŀ����������ﮣ�LiFePO4�����������Դ�����Ķ������֮һ������ʪ��ұ���ջ��շϾ���������﮵������Ƭ�еĽ��������������£�
���������������
A. ���������Ͼɵ�������ڱ�����������Դ������
B. �ӡ�����Ƭ���пɻ��յĽ���Ԫ����Al��Fe��Li
C. ����������Ӧ�Ľ�������ΪFe3+
D. ���������п��������ƴ���̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ,ij����X������H2��CO��CH4�е�һ�ֻ�����ɡ���X����ȼ��,��ȼ�պ����ɵ�����ͨ��A��B����ϴ��ƿ���Իش���������:
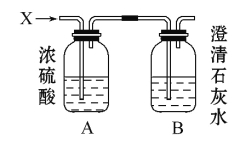
(1)��Aϴ��ƿ����������,Bϴ��ƿ����������,������X�� ��
(2)��Aϴ��ƿ����������,Bϴ��ƿ����������,������X�� ��
(3)��A��B����ϴ��ƿ������������,���Ʋ�X�����м������,��д�±���(�ж�����д������,��������)
��� | �� | �� | �� | �� | �� | �� |
X |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������ͼװ����ȡ�����Ȼ�������֪�Ȼ����۷е㶼�ܵ�(178������),����ˮ�⡣����˵������ȫ��ȷ��һ����
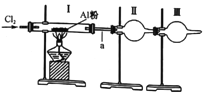
�������к���ˮ�������Ȼ����ͨ��ʢ�п����Ƶĸ���ܳ�ȥ
��װ��I�г�������ɫ������ټ���ʢ��A���۵�Ӳ�ʲ�����
��װ��II���ռ�װ�ã������ռ��Ȼ���
��װ��III��ʢ�ż�ʯ��Ҳ��ʢ����ˮ�Ȼ��ƣ����ߵ�������ͬ
��a��ʹ�ýϴֵĵ�����ʵ��ʱ����ȫ
A. �٢� B. �ڢۢ� C. �٢� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ��ĵ��ӹ�ҵѸ�ٷ�չ������˴����ĵ�·��ʴ�̷�Һ�IJ������ŷš�ʴ��Һ��Ҫ�����Ե�(HCl-H2O2)����ͳ��FeCl3��(HCl-FeCl3)�ȷ�����ʴ�̷�Һ�к��д�����Cu2+����Һ�Ļ������ÿɼ���ͭ��Դ����ʧ������ʴ�̷�Һ�ij��ô����������£�
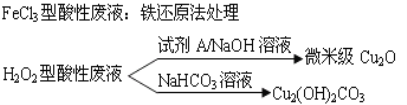
��1��FeCl3�����Է�Һ�û�ԭ������������Fe��Cl2�ֱ���Ϊ��ԭ�������������ɻ���ͭ��ʹʴ��Һ��������������Ҫ��ѧ��Ӧ�У�Fe+Cu2+=Fe2++Cu��Fe+2H+=Fe2++H2��������_______________��__________________��(�����ӷ���ʽ��ʾ)��
��2��HCl-H2O2��ʴ��Һʴ�̹����з����Ļ�ѧ��Ӧ�û�ѧ����ʽ�ɱ�ʾΪ��__________��
��3������H2O2�����Է�Һ����Cu2(OH)2CO3�Ĺ���������Ʒ�Ӧ���¶ȣ����¶ȸ���80��ʱ����Ʒ��ɫ��������ԭ�������____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷�Ni--MH����������Ͽ��Ʊ����Ӽ����������壬�乤����������ͼ��ʾ:
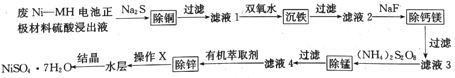
�ش���������:
(1)��Ni-NH������������������Һ�еijɷ�Ũ�����±���ʾ:
�ɷ� | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
Ũ��(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
��Һ��c(Ni2+)=_____mol/L(���������λ��Ч����)��
(2)�ڡ���Һ1���м���˫��ˮ�ɽ�Fe2+ת��Ϊ���ܵ�������(FeOOH),д����Ӧ�����ӷ���ʽ:___________��
(3)����Һ2���м���NaF�ɽ���Һ��Ca2+��Mg2+ת��Ϊ���ܵ�CaF2��MgF2�����������NaF�����á���Һ3����c(Mg2+):c(Ca2+)=0.67����MgF2���ܶȻ�Ϊ______[��֪Ksp(CaF2)=1.10��10-10]��
(4)�����̡�ʱ��(NH4)2S2O8�롰��Һ3���е�MnSO4��Ӧ���ɺ��̻�����R������識����ᣬ���������뻹ԭ�����ʵ���֮��Ϊ1:1����R�Ļ�ѧʽΪ_____��(����ĸ)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)����п��ʱ��Zn2+���л���ȡ��(��HA��ʾ)�γ���������ȡ���������ZnA2��2HA��
����д����ȡʱ��Ӧ�����ӷ���ʽ______________��
�ڡ���п��ʱ��п����ȡ������ҺpH�仯����ͼ��ʾ���Է���pH����ʱ��п����ȡ�����������ԭ����_____________________��
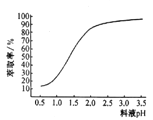
�ۡ�����X����������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ҳ��õ���Ʒ,���ݵ绯ѧԭ��,�������ԭ��ء�����д���пհ�:
(1)ʵ��ԭ��:Fe+2H+= ��
(2)ʵ����Ʒ:�缫( �� )(�����õ缫������)��ϡ���ᡢ�ձ������ߡ�����(�������)��
(3)ʵ��װ����ͼ��ʾ��
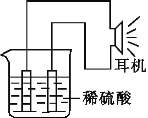
(4)ԭ��ع���ԭ������:
��ԭ��ع���ʱ,����Ϊ (�ѧʽ),���� (���������ԭ��),��缫��ӦʽΪ ,��һ�缫Ϊ����,���� ��Ӧ,��缫��ӦʽΪ ,���·�е�����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ú�ĸ���ʯ�͵ķ����������仯
B. ��ҵ�ϳ��ó���ʯ��ˮ��������Ӧ��Ư��
C. ��������Һ�м����������Һ������ͭ��Һ���ܲ�����ɫ��������������������
D. ���������������������ά�����ά��ǿ�������·��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Fe(OH)2��Cu(OH)2�ı�����Һ�У����������ӵ����ʵ���Ũ�ȵĸ�����[-lgc(M2+)]����ҺpH�ı仯��ϵ��ͼ��ʾ����֪���¶���Ksp[Cu(OH)2]<Ksp[Fe(OH)2]������˵����ȷ����

A. ����a��ʾFe(OH)2������Һ�еı仯��ϵ
B. ��ȥCuSO4��Һ�к��е�����Fe2+���ɼ�����CuO
C. ��Fe(OH)2��Cu(OH)2��������ʱ����Һ��c(Fe2+)��c(Cu2+)=104.6 ��1
D. ��X���Ӧ�ı�����Һ�м�������NaOH���壬��ת��ΪY���Ӧ����Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com