
【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
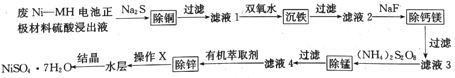
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
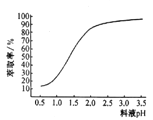
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
③“操作X”的名称是________________。
【答案】 1.773 2Fe2++H2O2+2H2O=2FeOOH↓+4H+ 7.37×10-11 a Zn2++4HA![]() ZnA2·2HA+2H+ 料液的pH增大,使料液中的c(H+)减小,促使Zn2++4HA
ZnA2·2HA+2H+ 料液的pH增大,使料液中的c(H+)减小,促使Zn2++4HA![]() ZnA2·2HA+2H+向右进行,锌的萃取率增大 分液
ZnA2·2HA+2H+向右进行,锌的萃取率增大 分液
【解析】(1)根据电荷守恒,2c(Ni2+)+0013 mol/L×2+0.0007 mol/L×2+0.0013 mol/L×2+0.0030 mol/L×2+0.004 mol/L×2+0.01 mol/L×1=1.8 mol/L×2,解得c(Ni2+)=1.773 mol/L,故答案为:1.773;
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH↓+4H+,故答案为:2Fe2++H2O2+2H2O=2FeOOH↓+4H+;
(3) “滤液3”中c(Mg2+):c(Ca2+)=0.67,因此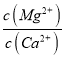 =
=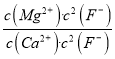 =
=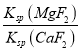 =
=![]() =0.67,因此Ksp(MgF2)= 7.37×10-11,故答案为:7.37×10-11;
=0.67,因此Ksp(MgF2)= 7.37×10-11,故答案为:7.37×10-11;
(4)设该反应中锰元素的化合价变化为+2价→+x价,失电子化合价升高,锰离子作还原剂;氧元素的化合价不变,所以S元素得电子化合价降低,S2O82-作氧化剂,S元素化合价变化为+7价→+6价,若氧化剂与还原剂物质的量之比为1:1,即(7-6)×2:(x-2)=1:1,解得x=4,只有a中MnO2中Mn元素的化合价为+4价,故选a;
(5)①“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA,反应的离子方程式为Zn2++4HA![]() ZnA2·2HA+2H+,故答案为:Zn2++4HA
ZnA2·2HA+2H+,故答案为:Zn2++4HA![]() ZnA2·2HA+2H+;
ZnA2·2HA+2H+;
②根据图像,料液的pH增大,使料液中的c(H+)减小,促使Zn2++4HA![]() ZnA2·2HA+2H+向右进行,锌的萃取率增大,故答案为:料液的pH增大,使料液中的c(H+)减小,促使Zn2++4HA
ZnA2·2HA+2H+向右进行,锌的萃取率增大,故答案为:料液的pH增大,使料液中的c(H+)减小,促使Zn2++4HA![]() ZnA2·2HA+2H+向右进行,锌的萃取率增大;
ZnA2·2HA+2H+向右进行,锌的萃取率增大;
③根据流程图,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA ,“操作X”为萃取后的分液,故答案为:分液。


科目:高中化学 来源: 题型:
【题目】有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A:___________________________。
C:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式
(1)钠在空气中加热__________________________________
(2)工业制漂白粉__________________________________
(3)氯气通入水中__________________________________
(4)次氯酸见光分解__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A.生成C的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间生成n mol A,同时生成3n mol B
D.A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空且充了氧气的注射器。
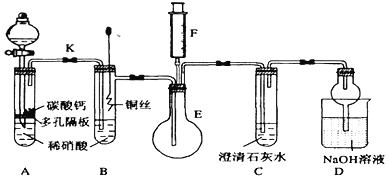
请回答有关问题:
(1)设计装置A的目的是___________________;为达到此目的,应如何操作?_____________。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是________; B中反应的离子方程式为:________________________;装置B有何优点_____________________________。
(3)装置E和F的作用是________________;为实现此作用,其操作方法是_____________________________。
(4)D装置中NaOH溶液的作用_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】走进化学变化的微观世界,有利于进一步认识化学变化。下图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:

反应前 反应后
(1)该化学反应中生成物的分子个数比为______________;
(2)从微观角度分析,化学反应前后各物质的质量总和相等的原因是__________________________________________________________;
(3)该化学反应的基本类型为_________________________________;
(4)由X原子构成的物质在该反应中____________(填“是”或“不是”)催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末可能含硫酸钡、碳酸钠、和氢氧化钡中的一种或几种,取一定量的该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到有白色不溶物。
小张同学认为,白色粉末中一定含有硫酸钡;
小李同学认为,小张同学的结论不准确,其理由可用化学方程式表示为______________。
针对上述两名同学的观点,小刘同学进一步设计如下实验方案进行探究:

(1)步骤③中,滴入酚酞溶液后,若滤液E为红色,则滤液E中除酚酞外还一定含有的溶质是_______(填化学式,下同),由此得出原白色粉末成分组成的结论是______________。
(2)小王同学认为,只需要取少量滤渣B,加入过量的稀盐酸,若看到的现象是白色不溶物部分溶解,且有气泡产生,就足以说明原白色粉末的成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
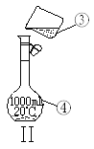
【题目】下图为两套实验装置。
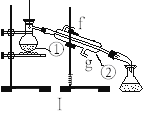
⑴写出下列仪器的名称: ①________________;②________________ 。
⑵仪器①~④中,使用时必须检查是否漏水的有_____________。(填序号)
⑶若利用装置I制取蒸馏水,还缺少的仪器是_____________,将仪器补充完整后进行实验,冷却水从_______口进。
⑷现需配制1.0 mol·L-1的NaOH溶液240mL,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 ___________________ 、_____________________ 。
⑸配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为_____________________。
⑹某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为______g,该同学应称量______g NaOH。
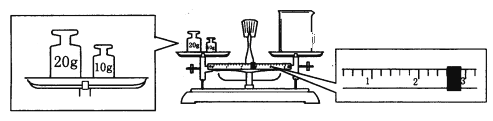
⑺在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是__________。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量溶液洒到容量瓶外面 ③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线 ⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com