
【题目】有一包白色粉末可能含硫酸钡、碳酸钠、和氢氧化钡中的一种或几种,取一定量的该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到有白色不溶物。
小张同学认为,白色粉末中一定含有硫酸钡;
小李同学认为,小张同学的结论不准确,其理由可用化学方程式表示为______________。
针对上述两名同学的观点,小刘同学进一步设计如下实验方案进行探究:

(1)步骤③中,滴入酚酞溶液后,若滤液E为红色,则滤液E中除酚酞外还一定含有的溶质是_______(填化学式,下同),由此得出原白色粉末成分组成的结论是______________。
(2)小王同学认为,只需要取少量滤渣B,加入过量的稀盐酸,若看到的现象是白色不溶物部分溶解,且有气泡产生,就足以说明原白色粉末的成分是__________________。
【答案】Na2CO3 + Ba(OH)2 ==== BaCO3 ↓ + 2NaOHNaOH NaCl BaCl2BaSO4 Na2CO3 Ba(OH)2 或 Na2CO3 Ba(OH)2BaSO4 Na2CO3 Ba(OH)2
【解析】
(1)碳酸钠和氢氧化钡反应会生成碳酸钡沉淀和和氢氧化钠,化学方程式为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,则答案为:Na2CO3 + Ba(OH)2 ==== BaCO3 ↓ + 2NaOH;(2)向烧杯中的溶液中加入几滴酚酞试液,若溶液变红,就可证明其中含有氢氧化钠,同是原粉末中含有氢氧化钡,而在步骤②中加入过量的氯化钡有沉淀生成,故原粉末中一定含有碳酸钠,故答案为:NaOH、NaCl、BaCl2 ;BaSO4、Na2CO3、Ba(OH)2 或 Na2CO3、Ba(OH)2 ; (3)加入过量的稀盐酸,沉淀部分溶解,说明一定含有硫酸钡,而碳酸钠和氢氧化钡是一定含有的,故答案为:BaSO4、Na2CO3、Ba(OH)2。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
如图是制取溴苯的装置。试回答:

(1)装置A中发生反应的化学方程式是_________________________。
(2)装置C中看到的现象是____________________,证明________________________。
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是________,原因是____________。
如果没有B装置而将A、C直接相连,你认为是否妥当?________(填“是”或“否”),理由是______________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯______________(填“上”或“下”)层为溴苯,这说明溴苯______________且______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是
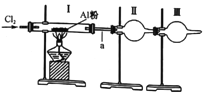
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
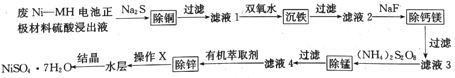
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
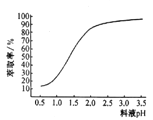
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
③“操作X”的名称是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用实验室常用的物品,根据电化学原理,可以设计原电池。请填写下列空白:
(1)实验原理:Fe+2H+= 。
(2)实验用品:电极( 、 )(填所用电极的名称)、稀硫酸、烧杯、导线、耳机(或电流计)。
(3)实验装置如图所示。
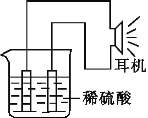
(4)原电池工作原理分析:
该原电池工作时,负极为 (填化学式),发生 (填“氧化”或“还原”),其电极反应式为 ,另一电极为正极,发生 反应,其电极反应式为 ,外电路中电子流动方向为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
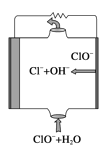
A.放电过程中OH-移向正极
B.电池的总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl-
C.镁电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 煤的干馏、石油的分馏都是物理变化
B. 工业上常用澄清石灰水和氯气反应制漂白粉
C. 蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析”
D. 二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:
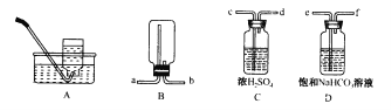
(1)实验室利用A装置收集氧气的最佳时刻是_________________________。
(2)用收集到的氧气完成硫粉燃烧实验后,还需向集气瓶内加入适量氢氧化钠溶液,目的是_______________________(用化学方程式表示)。
(3)实验室制取二氧化碳若用B装置收集,则气体应从________端进入,制取的二氧化碳中常含有少量的氯化氢气体与水蒸气,欲使用C、D装置将以上杂质除去,则装置正确的连接顺序是_____________(用C、D装置端口字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1 mol·L-1的H2SO4溶液,B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是( )
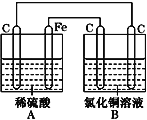
A. A为原电池,B为电解池
B. A为电解池,B为原电池
C. 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D. 经过一段时间,A烧杯中溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com