
【题目】有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A:___________________________。
C:___________________________。
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有 |
B | 向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 |
|
C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰焰色为紫色 | 原溶液中一定只含 |
D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见砖红色沉淀生成 | 淀粉未发生水解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A. CO2的电子式:![]() B. 质量数为37的氯原子:
B. 质量数为37的氯原子:![]() l
l
C. NH4Cl的电子式:![]() D. 原子核内有10个中子的氧原子:
D. 原子核内有10个中子的氧原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在同一溶液中能大量共存的是( )
A.Na+、CO32﹣、SO42﹣、H+
B.K+、AlO2﹣、H+、Cl﹣
C.Fe2+、K+、H+、NO3﹣
D.Al3+、H+、NO3﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
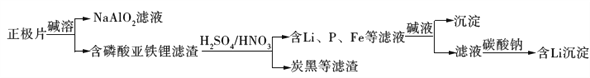
下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。请回答下列问题:

(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点______(填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响且理由是_______。
(3)图中A表示SO2(g)和O2(g) 的_________。图中△H的意义是__________。
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式__________;V2O5对该反应进行的程度有无影响 _____________
(5)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
如图是制取溴苯的装置。试回答:

(1)装置A中发生反应的化学方程式是_________________________。
(2)装置C中看到的现象是____________________,证明________________________。
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是________,原因是____________。
如果没有B装置而将A、C直接相连,你认为是否妥当?________(填“是”或“否”),理由是______________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯______________(填“上”或“下”)层为溴苯,这说明溴苯______________且______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是
A. K+不一定存在 B. Ba2+、Mg2+不一定都存在
C. Cl-不一定存在 D. 混合溶液中CO32-的浓度为0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
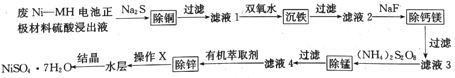
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
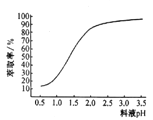
③“操作X”的名称是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com