
【题目】下列实验操作、现象和得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有 |
B | 向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 |
|
C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰焰色为紫色 | 原溶液中一定只含 |
D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见砖红色沉淀生成 | 淀粉未发生水解 |
A. A B. B C. C D. D
【答案】B
【解析】A,酸性KMnO4溶液具有强氧化性能将Fe2+氧化成Fe3+,向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液,溶液最终变为红色,原溶液中可能含Fe3+,也可能含Fe2+,A项错误;B,向浓度均为0.1mol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液,出现黄色沉淀,说明先生成AgI沉淀,则Ksp(AgCl)![]() Ksp(AgI),B项正确;C,用洁净的铂丝蘸取某溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰焰色为紫色,原溶液中一定含K+,因为蓝色钴玻璃滤去了黄光,原溶液中还可能含Na+,C项错误;D,淀粉水解液中含稀硫酸,加入的Cu(OH)2与稀硫酸反应,不能检验水解液中是否含葡萄糖,正确的方法:在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液加入NaOH溶液至溶液呈碱性,再加入新制Cu(OH)2加热煮沸,若出现砖红色沉淀表明淀粉发生了水解,若未见砖红色沉淀表明淀粉未发生水解,D项错误;答案选B。
Ksp(AgI),B项正确;C,用洁净的铂丝蘸取某溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰焰色为紫色,原溶液中一定含K+,因为蓝色钴玻璃滤去了黄光,原溶液中还可能含Na+,C项错误;D,淀粉水解液中含稀硫酸,加入的Cu(OH)2与稀硫酸反应,不能检验水解液中是否含葡萄糖,正确的方法:在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液加入NaOH溶液至溶液呈碱性,再加入新制Cu(OH)2加热煮沸,若出现砖红色沉淀表明淀粉发生了水解,若未见砖红色沉淀表明淀粉未发生水解,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是新型多功能水处理剂。其生产工艺如下:

回答下列问题:
(1)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,写出温度较高时反应的离子方程式____________。
(2)在溶液I中加入NaOH固体的目的是_______(填字母)。
A.与反应液I中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使NaClO3转化为NaClO
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图1为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4的生成率的影响。

工业生产中最佳温度为_______,此时Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比为_____。
(4)反应③中的离子反应方程式为_________________;溶液Ⅱ中加入饱和KOH得到湿产品的原因是__________________。
(5)高铁酸钾作为水处理剂是能与水反应其离子反应是:4FeO42-+l0H2O=4Fe(OH)3(胶体)十3O2↑+8OH-。则其作为水处理剂的原理是:①_______________;②_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为制取硝酸铜,某同学设计了如下四种方法:①铜与浓硝酸反应制取硝酸铜;②铜与稀硝酸反应制取硝酸铜;③铜先与空气反应制取氧化铜,再与硝酸反应制取硝酸铜;④铜与硝酸银溶液反应制取硝酸铜。
(1)方法②中被氧化的铜与被还原的硝酸的物质的量之比是 。
(2)“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,杜绝污染源,提高原子利用率是绿色化学的重要衡量指标。请从“绿色化学”和经济效益角度考虑,大量制取硝酸铜宜采用上述第 (填序号)种方法,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法中
①结构片段为…… ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚
②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应:![]()
⑤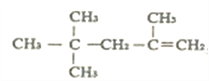 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有 个。
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(![]() )是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:

已知主反应:![]()
![]()
![]() H<0
H<0
副反应:![]() 50℃时
50℃时![]() 开始分解
开始分解

请回答下列问题:
(1)步骤①的关键是_____________,其原因是______________________。
(2)在滤液X中加入适量NaCl固体的目的是________________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是_______________________。
(4)下列物质中,会引起过碳酸钠失效的有____________。
A.![]() B.
B.![]() C.
C.![]() D.HCl
D.HCl
(5)过碳酸钠的产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶液→加入![]() 溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量
溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量![]() g,沉淀的质量
g,沉淀的质量![]() g,则产品中过碳酸钠质量分数的表达式为:___________。
g,则产品中过碳酸钠质量分数的表达式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,把溴置换出来,再用空气将嗅吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有①_________________(写出化学方程式);②3Br2+3CO![]() ===BrO
===BrO![]() +5Br-+3CO2↑;③BrO
+5Br-+3CO2↑;③BrO![]() +5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
+5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:______________________。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是________(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A:___________________________。
C:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com