
【题目】苯并环己酮是合成萘(![]() )或萘的取代物的中间体。由苯并环己酮合成1-乙基萘的一种路线如图所示:
)或萘的取代物的中间体。由苯并环己酮合成1-乙基萘的一种路线如图所示:
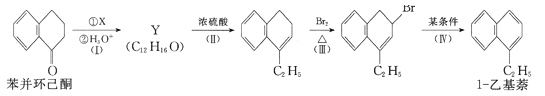
已知: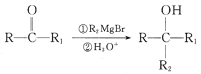
回答下列问题:
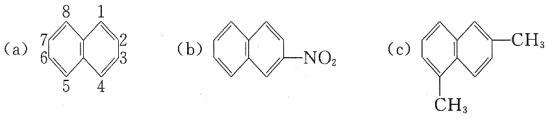
(1)萘环上的碳原子的编号如(a)式,根据系统命名法,(b)式可称为2-硝基萘,则化合物(c)的名称应是__。
(2)有机物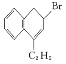 含有的官能团是__(填名称),X的结构简式是__。
含有的官能团是__(填名称),X的结构简式是__。
(3)步骤III的反应类型是__,步骤IV的反应类型是__。
(4)反应II的化学方程式是__。
(5)1-乙基萘的同分异构体中,属于萘的取代物的有__种(不含1-乙基蔡)。W也是1-乙基萘的同分异构体,它是含一种官能团的苯的取代物,核磁共振氢谱显示W有3种不同化学环境的氢,峰面积比为1:1:2,W的结构简式为__。
(6)写出用CH3COCH3和CH3MgBr为原料制备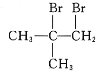 的合成路线(其他试剂任选)。__。
的合成路线(其他试剂任选)。__。
【答案】1,6-二甲基萘 碳碳双键和溴原子 C2H5MgBr 取代反应 消去反应 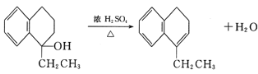 11
11 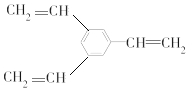

【解析】
Y分子组成比苯并环己酮多C2H6,结合信息、Y反应后产物结构,可知X为C2H5MgBr,生成Y的整个过程相当于与乙醇发生加成反应,可知Y的结构简式为: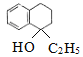 ,反应II为消去反应,III为取代反应,IV为消去反应;
,反应II为消去反应,III为取代反应,IV为消去反应;
(l)根萘环上的碳原子的编号可知,甲基分别取代了1号和6号碳上的氢原子,所以化合物(c)名称是1,6-二甲基萘;
(2)有机物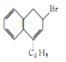 含有的官能团是碳碳双键和溴原子,通过以上分析知,X为C2H5MgBr;
含有的官能团是碳碳双键和溴原子,通过以上分析知,X为C2H5MgBr;
(3)步骤Ⅲ的反应属于取代反应,步骤Ⅳ反应类型是消去反应;
(4)Y为 ,反应II为醇的消去反应,则反应Ⅱ的化学方程式是
,反应II为醇的消去反应,则反应Ⅱ的化学方程式是 ;
;
(5)可以有一个取代基为乙基,有2位置(包含1-乙基萘)。可以有2个取代基,为2个甲基,可以处于同一苯环上,确定一个甲基位置,另外甲基位置如图所示: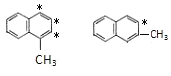 ,有4种,若处于不同苯环上,确定一个甲基位置,另外甲基位置如图所示:
,有4种,若处于不同苯环上,确定一个甲基位置,另外甲基位置如图所示: ,有6种,不包括1-乙基萘,符合条件的有2+4+6-1=11种;
,有6种,不包括1-乙基萘,符合条件的有2+4+6-1=11种;
W也是1-乙基萘的同分异构体,它是含一种官能团的苯的取代物,则含有3个碳碳双键,核磁共振氢谱显示W有三种不同化学环境的氢原子,具有高对称性,且个数比为1:1:2,含有3个-CH=CH2且处于间位,其结构简式为: ;
;
(6)以CH3COCH3、CH3MgBr为原料合成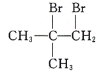 ,
,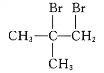 可由CH2=C(CH3)2和溴发生加成反应得到,CH2=C(CH3)2可由(CH3)3COH发生消去反应得到,(CH3)3COH可由CH3COCH3、CH3MgBr反应得到,合成路线图为
可由CH2=C(CH3)2和溴发生加成反应得到,CH2=C(CH3)2可由(CH3)3COH发生消去反应得到,(CH3)3COH可由CH3COCH3、CH3MgBr反应得到,合成路线图为 。
。


科目:高中化学 来源: 题型:
【题目】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如图:

请回答下列问题:
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为__。
(2)溶液A中溶质除NaOH外,还有__。
(3)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有__(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是__。
③“钴渣”中LiCoO2溶解时的离子方程式为__。
(4)在“滤液1”中加入20﹪Na2CO3溶液,目的是__;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是__。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热。使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业、上常用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及铁红,其生产流程如图:
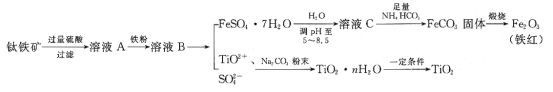
已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:
(1)钛铁矿用硫酸溶解时,过滤所得滤渣的成分是__(填化学式)。
(2)从溶液B中得到FeSO4·7H2O晶体的操作是__、过滤、洗涤、干燥。
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是__。
(4)煅烧FeCO3,发生反应的化学方程式是__。
(5)流程中加入Na2CO3粉末得到固体TiO2·nH2O。请结合TiO2+的水解平衡原理解释其原因:__。
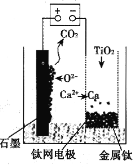
(6)用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制取金属钛。阳极反应式是__,反应过程中CaO的物质的量__(填“减小”“不变”或“增大”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
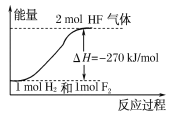
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)ΔH=﹣1367.0 kJ·![]() (燃烧热)
(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) ΔH=+57.3 kJ·![]() (中和热)
(中和热)
C.S(s)+O2(g)=SO2(g) ΔH=﹣269.8 kJ·![]() (反应热)
(反应热)
D.2NO2=O2+2NO ΔH=+116.2 kJ·![]() (反应热)
(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在800 mL的大烧杯中放入碎纸屑把盛有50 mL 0.50 mol·L-1盐酸的100 mL烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑料板做成大烧杯盖,通过盖子插入一根环形玻璃搅拌棒和一支温度计,测定溶液的温度。迅速往盐酸中加入 50 mL 0.55 mol·L-1NaOH溶液,盖好盖子,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装有反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。
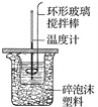
(1)烧杯间填满碎纸屑的作用是____________。
(2)要重复进行三次实验的目的是_____________。
(3)烧杯若不盖泡沫塑料板,求得的中和热数值将________(填“偏大”“偏小”或“无影响”)。
(4)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1NaOH溶液进行上述反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),理由是_______。
(5)三次实验测得的数据中,起始时盐酸与NaOH溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.5 ℃。则最终代入计算式的温度差的平均值为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计如下实验。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100℃时开始升华,157℃时大量升华并开始分解;草酸蒸气在低温下迅速冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:

①装置的连接顺序为:A→D→____→____→F→E→C→G。
②装置中冰水混合物的作用是____。
③整套装置存在不合理之处为____。
Ⅱ.乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol/L的草酸溶液480mL。
(2)配制该溶液需要草酸晶体____g。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是____。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1mol/L草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
D.测定草酸钠溶液的pH
(4)该小组同学将0.1mol/L草酸溶液和0.1mol/L的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为____。
Ⅲ.乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“诺龙”属于国际奥委会明确规定的违禁药品类固醇,其结构简式如下图所示。下列关于“诺龙”的说法中,不正确的是
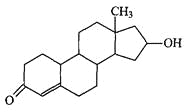
A.分子式是C18H26O2
B.既能发生加成反应,也能发生酯化反应
C.能在NaOH醇溶液中发生消去反应
D.既能发生氧化反应,也能发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com