
【题目】下列过程都与热量变化有关,其中表述不正确的是
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO (g)+![]() O2(g)=CO2(g)△H=—283.0 kJ/mol
O2(g)=CO2(g)△H=—283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l)△H=—57.3 kJ/mol
BaSO4(s)+H2O(l)△H=—57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
【答案】B
【解析】
A项、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,表示CO(g)燃烧热的热化学方程式为CO (g)+![]() O2(g)=CO2(g)△H=—283.0 kJ/mol,故A正确;
O2(g)=CO2(g)△H=—283.0 kJ/mol,故A正确;
B项、中和热是稀强酸溶液和稀强碱溶液恰好反应生成1mol水放出的热量,因SO42-和Ba2+反应生成BaSO4沉淀会放出热量,所以反应热小于—57.3kJ/mol,故B错误;
C项、铝热反应是放热反应,但需要足够的热量,高温条件下才能发生反应,故C正确;
D项、水的电离过程是吸热过程,升高温度,平衡向右移动,溶液中氢离子浓度和氢氧根离子浓度增大,水的离子积常数增大,溶液pH减小,故D正确;
故选B。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
![]() 已知:①
已知:①![]()
②![]()
③![]() .
.
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ______ .
![]() 生产甲醇的原料CO和
生产甲醇的原料CO和![]() 可由反应
可由反应![]() 得到.
得到.
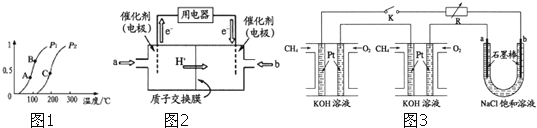
①一定条件下![]() 的平衡转化率与温度、压强的关系如图
的平衡转化率与温度、压强的关系如图![]() 则
则![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() 、B、C三点处对应平衡常数
、B、C三点处对应平衡常数![]() 、
、![]() 、
、![]() 的大小顺序为 ______ .
的大小顺序为 ______ .
②![]() 时,将
时,将![]() 和
和![]() 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______ ![]() 填序号
填序号![]() .
.
![]() .容器的压强恒定
.容器的压强恒定
![]() .容器内气体密度恒定
.容器内气体密度恒定
![]() 正
正![]() 逆
逆![]()
![]() 单位时间内消耗
单位时间内消耗![]() 同时生成
同时生成![]()
![]() 甲醇燃料电池
甲醇燃料电池![]() 简称
简称![]() 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() ,其电极反应式为 ______ .
,其电极反应式为 ______ .
![]() 某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为
某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为![]() 闭合K后,若每个电池甲烷用量均为
闭合K后,若每个电池甲烷用量均为![]() 标况
标况![]() ,且反应完全,则理论上通过电解池的电量为 ______
,且反应完全,则理论上通过电解池的电量为 ______ ![]() 列式计算.法拉第常数
列式计算.法拉第常数![]() ,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系不正确的是( )
A.等质量的烃完全燃烧消耗氧量:甲烷>乙烷>乙烯>苯
B.熔点:正戊烷>2,2–二甲基戊烷>2,3–二甲基丁烷>丙烷
C.密度:CCl4>CH2Cl2>H2O>苯
D.![]() 的一氯取代产物有4种
的一氯取代产物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )

A.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
C.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 准确量取25.00mL的液体可选用移液管、量筒或滴定管等量具
B. 实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗
C. 用分液漏斗分液时要经过振荡、放气、静置后,从上口倒出上层液体,再打开旋塞,将下层液体从下口放出
D. 在中和热测定实验中,盐酸和NaOH溶液的总质量mg,反应前后体系温度变化为t,反应液的比热容为![]() ,则生成1mol水放出的热量为
,则生成1mol水放出的热量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH和盐酸都是中学化学常见的试剂
(一)某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度
(1)将5.0g烧碱样品( 杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,用________式滴定管量取,下图是某次滴定时的滴定管中的液面,其读数为________ mL。

(2)由下表数据, NaOH的百分含量是________。
滴定次数 | 待测NaOH溶液体积(mL) | 标准盐酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(3)用标准盐酸滴定某浓度的NaOH溶液,下列操作可能使测定结果偏高的是(_____)
A.用蒸馏水洗锥形瓶后,直接取10.00 mL待测液注入锥形瓶中
B.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
D.对酸式滴定管,滴定前正确读数,滴定后俯视读数
(二)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:

(4)从实验装置上看,图中缺少的一种玻璃用品是__________。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将________( 填“偏大”、“偏小”或“无影响”)。
(5)已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:_______________。
(三)常温时,向盛有0.1 mol·L-1Mg2+溶液的试管中滴加适量的NaOH溶液,到pH为11.0时(已知Ksp Mg(OH)2=5.61×1012)
(6)此时上层清液中c(Mg2+)=________ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5mol/L、MgCO3的饱和溶液中c(Mg2+)为2.6×10-3mol/L.若在5mL浓度均为0.01mol/L的CaCl2和MgCl2溶液中,逐滴加入5mL 0.012mol/LNa2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A. 25℃时,Ksp(CaCO3)=2.8×10-9
B. 加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C. 滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO3-)>c(OH-)
D. 滤液M中: 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com