
【题目】下列实验装置正确的是( )
A.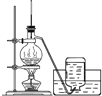 实验室制乙烯B.
实验室制乙烯B. 酯化反应
酯化反应
C. 实验室制取Cl2D.
实验室制取Cl2D.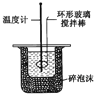 中和热的测定
中和热的测定
【答案】D
【解析】
A. 实验室制取乙烯需要170℃,温度计测量温度为溶液温度;
B. 酯化反应中导气管不能伸入饱和碳酸钠溶液中;
C. 制取氯气时,尾气处理应该防止倒吸现象;
D. 中和热测定中,温度计测量混合溶液温度,用环形玻璃棒搅拌溶液。
A. 实验室制取乙烯需要170℃,温度计要测量溶液温度,所以温度计应该插入溶液中,A错误;
B. 酯化反应中导气管不能伸入饱和碳酸钠溶液中,否则会产生倒吸现象,B错误;
C. 制取氯气时,尾气处理应该要防止倒吸,尾气处理装置中应该有倒置的漏斗,C错误;
D. 中和热测定中,温度计测量混合溶液温度,用环形玻璃棒搅拌溶液,使溶液温度混合均匀,符合实验条件,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】根据图示填空:
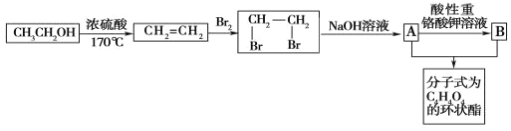
已知:R-Br+NaOH(溶液)→R-OH+NaBr
(1)写出图中 A、B 的结构简式:A_____,B_____。
(2)写出上述转化关系图中 A+B→C 的化学方程式(有机物用结构简式表示)_________________;并写出反应类型:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定量混合气体发生下列反应:aA(g) + bB(g) ![]() cC(g) + dD(g) ,达到平衡后,测得C气体的浓度为0.5mol/L。恒温下,将密闭容器的体积缩小为1/2 ,再达平衡时,测得C气体的浓度为0.9mol/L。则下列叙述正确的是
cC(g) + dD(g) ,达到平衡后,测得C气体的浓度为0.5mol/L。恒温下,将密闭容器的体积缩小为1/2 ,再达平衡时,测得C气体的浓度为0.9mol/L。则下列叙述正确的是
A. C的体积分数增大B. 平衡向右移动
C. B的转化率提高D. a+b < c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程都与热量变化有关,其中表述不正确的是
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO (g)+![]() O2(g)=CO2(g)△H=—283.0 kJ/mol
O2(g)=CO2(g)△H=—283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l)△H=—57.3 kJ/mol
BaSO4(s)+H2O(l)△H=—57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将FeCl3饱和溶液煮沸可得到带正电荷的Fe(OH)3胶体
B.0.5 molH2SO4与0.5 molBa(OH)2完全反应所放出的热量即为中和热
C.H2O的沸点高于H2S是因为O-H键的键能大于S-H键的键能
D.向新制氯水中加入CaCO3可使溶液中HClO浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:

下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:A.金刚石、B.MgF2、C.NH4Cl、D.固体碘,用序号填写空白:既存在离子键又存在共价键的是______,熔化时不需破坏化学键的是______。
(2)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 molN-N键吸收167 kJ热量,生成1 molN≡N键放出942 kJ热量。根据以上信息和数据,则1molN4完全转化为N2______(填“放出”或“吸收”)热量______kJ。

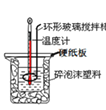
(3)50 mL 0.50 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在如图2所示的装置中进行中和反应。请回答下列问题:如图,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值______(填“偏大”、“偏小”或“无影响”)。
(4)向50mL0.50 mol/L的NaOH溶液中分别加入稀醋酸、稀盐酸、浓硫酸,则恰好完全反应时的放出热量Q1、Q2、Q3从大到小的排序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
编号 | 浓度/(mol·L-1) | 浓度/(mol·L-1) | 液的 pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=11 |
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?___________
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:____________________
(3)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式表示):c(Na+)-c(A-)=______mol·L-1。
(4)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
在0.1 mol·L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1 B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(H+)=c(OH-)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的工业原料,利用甲醇可以制氢气.
Ⅰ.甲醇与水蒸气反应可以直接制得氢气.
已知CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H>0,一定条件下,向体积为2L的恒容器密闭容器中充入1.2molCH3OH(g)和2.8molH2O(g),实验测得,反应共吸收的能量和甲醇的体积分数随时间变化的曲线图象如图1.
CO2(g)+3H2(g)△H>0,一定条件下,向体积为2L的恒容器密闭容器中充入1.2molCH3OH(g)和2.8molH2O(g),实验测得,反应共吸收的能量和甲醇的体积分数随时间变化的曲线图象如图1.
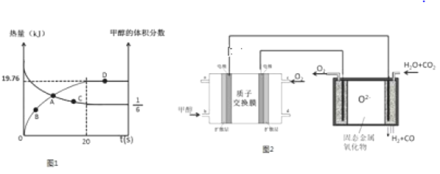
(1)从反应开始至平衡,H2的平均反应速率为___________.
(2)该条件下,CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的△H=__________,该反应的平衡常数为__________.
CO2(g)+3H2(g)的△H=__________,该反应的平衡常数为__________.
(3)在D点时,将容器的体积压缩为原来的一半,同时再充入7.2mol的H2O(g),CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)平衡_________________移动(填“往左”、“往右”或“不”).
CO2(g)+3H2(g)平衡_________________移动(填“往左”、“往右”或“不”).
Ⅱ.将甲醇燃料电池高温电解等物质的量的H2O﹣CO2混合气体可以间接制备H2.其基本原理如图2所示.
(4)甲醇燃料电池以酸性溶液为电解质,写出电池负极的电极反应式_________.
(5)电解池中发生的总反应方程式为_________________.
(6)当质子交换膜中通过的H+数目为4.816×1023时,理论上电解池中产生的H2为_______________L(标准状况).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com