
【题目】(1)已知:A.金刚石、B.MgF2、C.NH4Cl、D.固体碘,用序号填写空白:既存在离子键又存在共价键的是______,熔化时不需破坏化学键的是______。
(2)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 molN-N键吸收167 kJ热量,生成1 molN≡N键放出942 kJ热量。根据以上信息和数据,则1molN4完全转化为N2______(填“放出”或“吸收”)热量______kJ。

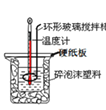
(3)50 mL 0.50 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在如图2所示的装置中进行中和反应。请回答下列问题:如图,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值______(填“偏大”、“偏小”或“无影响”)。
(4)向50mL0.50 mol/L的NaOH溶液中分别加入稀醋酸、稀盐酸、浓硫酸,则恰好完全反应时的放出热量Q1、Q2、Q3从大到小的排序是______。
【答案】C D 放出 882 保温隔热,防止热量散失 偏小 Q3>Q2>Q1
【解析】
(1)非金属元素之间易形成共价键、活泼金属和活泼非金属元素之间易形成离子键,铵根离子和酸根离子之间存在离子键;分子晶体熔化时破坏分子间作用力而不破坏化学键;原子晶体熔融时破坏共价键,分子晶体熔沸点较低;
(2)△H=反应中吸收的总热量与放出的总热量的差;
(3)该实验中还缺少环形玻璃搅拌棒;泡沫有保温性能;大烧杯上如不盖硬纸板,会导致部分热量散失;
(4)注意弱电解质的电离需要吸收热量,浓硫酸溶于水会放出热量,据此进行解答。
(1)A.金刚石中只存在共价键,
B.MgF2中只存在离子键;
C.NH4Cl为离子化合物,含有离子键、共价键;
D.固体碘是非分子晶体,在I2中含有共价键,在分子之间存在分子间作用力;
则既存在离子键又存在共价键的是C;熔化时不需破坏化学键的是分子晶体固体碘,则熔化时破坏分子间作用力而不破坏化学键D,故答案为:C;D;
(2)反应热等于反应中吸收的总热量与放出的总热量的差,则△H= (6×167-2×946) kJ/mol=-882 kJ/mol,说明1 molN4完全转化为N2放出882 kJ热量,故答案为:放出;882;
(3)泡沫有保温性能,所以其作用是保温隔热,防止热量散失;大烧杯上如不盖硬纸板,会导致部分热量散失,导致测定结果偏小,故答案为:保温隔热,防止热量散失;偏小;
(4)强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol;
分别向50 mL0.50 mol/L的NaOH溶液中加入:稀醋酸、稀盐酸、浓硫酸,醋酸为弱电解质,醋酸的电离吸热,浓硫酸溶于水放热,则恰好完全反应时的放出的热量大小关系为:浓硫酸![]() 稀盐酸
稀盐酸![]() 醋酸,则反应放出热量Q3>Q2>Q1,故答案为:Q3>Q2>Q1。
醋酸,则反应放出热量Q3>Q2>Q1,故答案为:Q3>Q2>Q1。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
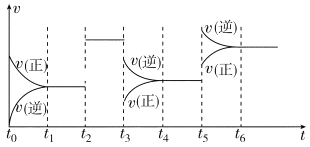
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间内X转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )

A.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
C.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.中和热的热化学方程式2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l);△H=-57.3 kJ/mol
B.氢气燃烧热的热化学方程式:H2(g)+![]() O2(g)=H2O(g);△H=-241.8 kJ/mol
O2(g)=H2O(g);△H=-241.8 kJ/mol
C.H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO4-+6H+=518O2↑+2Mn2++8H2O
D.向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH和盐酸都是中学化学常见的试剂
(一)某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度
(1)将5.0g烧碱样品( 杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,用________式滴定管量取,下图是某次滴定时的滴定管中的液面,其读数为________ mL。

(2)由下表数据, NaOH的百分含量是________。
滴定次数 | 待测NaOH溶液体积(mL) | 标准盐酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(3)用标准盐酸滴定某浓度的NaOH溶液,下列操作可能使测定结果偏高的是(_____)
A.用蒸馏水洗锥形瓶后,直接取10.00 mL待测液注入锥形瓶中
B.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
D.对酸式滴定管,滴定前正确读数,滴定后俯视读数
(二)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:

(4)从实验装置上看,图中缺少的一种玻璃用品是__________。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将________( 填“偏大”、“偏小”或“无影响”)。
(5)已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:_______________。
(三)常温时,向盛有0.1 mol·L-1Mg2+溶液的试管中滴加适量的NaOH溶液,到pH为11.0时(已知Ksp Mg(OH)2=5.61×1012)
(6)此时上层清液中c(Mg2+)=________ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解化学方程式或水解离子方程式正确的是 ( )
A.NH4+ + H2O = NH3·H2O + H+B.CH3COO— + H2O![]() CH3COOH + OH—
CH3COOH + OH—
C.CH3COOH + NaOH![]() CH3COONa + H2OD.NaCl + H2O
CH3COONa + H2OD.NaCl + H2O![]() NaOH + HCl
NaOH + HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:aA(g)+ bB(g)![]() cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
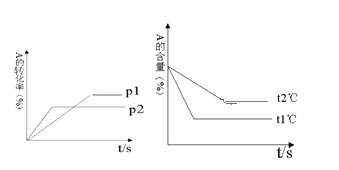
(1)压强p1 _________p2(填“>”或“<”);
(2)a +b__________c +d(填“>”或“<”);
(3)温度t1℃_________t2℃(填“>”或“<”);
(4)正反应为_________反应。(填吸热或放热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化。下列说法不正确的是( )

A.将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同
B.α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个
C.若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3
D.δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com