
【题目】在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )

A.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
C.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好
科目:高中化学 来源: 题型:
【题目】在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。请回答下列问题:
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。请回答下列问题:
(1)化学计量数a的值为________。
(2)下列能说明该反应达到了化学平衡状态的是________(填序号)。
a.容器内压强一定 b.容器内气体的密度一定
c.容器内Z的分子数一定 d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是________kJ。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2 mol X和1 mol Y,发生题给反应并达到平衡,则________(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M________N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2 mol X和1 mol Y在容器M中反应并达到平衡,X的平衡转化率为50%,则该温度为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)偏铝酸钠溶液中逐滴加入盐酸至过量,可观察到的现象是____________________,反应的离子方程式是____________________________、____________________________。
(2)偏铝酸钠溶液中持续不断地通入二氧化碳,可观察到的现象是________________,反应的离子方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 56g铁在足量氧气中燃烧,转移的电子数为2NA
B. lg氢气含有NA个氢气分子
C. 标准状况下,22.4L水含有1mol水分子
D. 2mol钠与过量稀盐酸反应生成NA个氢气分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯酸钾与密度为1.19gcm﹣3,溶质质量分数为36.5%的浓盐酸反应制取氯气。
I.反应方程式如下:___KClO3+ HCl= KCl+ Cl2↑+ H2O
(1)配平方程式,并用双线桥法表示上述反应中电子转移的方向和数目。
(2)若反应中被氧化的盐酸为5mol,则生成的氯气体积为__________(标准状况下)。
II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:

(1)证明氯气和水反应的实验现象为__________,反应的化学方程式是__________。
(2)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是__________,漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是__________。
III.乙同学用上述浓盐酸配置0.100 mol·L-1的稀盐酸480 mL,下列说法正确的是__________。
A.取用240 mL的容量瓶
B.应量取上述浓盐酸的体积为4.2mL
C.定容摇匀后发现液面低于刻度线,再加蒸馏水与刻度线相切,所配溶液浓度偏小
D.定容时,仰视刻度线所配溶液浓度偏大
E.量取上述浓盐酸的体积时俯视刻度线所配溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法进行制备:SiO2![]() Si(粗)
Si(粗) ![]() SiHCl3
SiHCl3![]() Si(纯)。下列说法正确的是( )
Si(纯)。下列说法正确的是( )
A.反应①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.反应①②③中每生成或消耗1 mol Si,转移4 mol电子
C.二氧化硅与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点31.8 ℃)中含有少量的SiCl4(沸点57.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池(如图)工作时,下列叙述正确的是( )
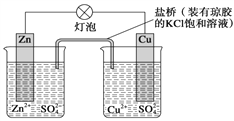
A. 正极反应为Zn-2e-==Zn2+
B. 电池反应为Zn+Cu2+==Zn2++Cu
C. 盐桥中的K+移向ZnSO4溶液
D. 在外电路中,电流从负极流向正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com