
【题目】下列水解化学方程式或水解离子方程式正确的是 ( )
A.NH4+ + H2O = NH3·H2O + H+B.CH3COO— + H2O![]() CH3COOH + OH—
CH3COOH + OH—
C.CH3COOH + NaOH![]() CH3COONa + H2OD.NaCl + H2O
CH3COONa + H2OD.NaCl + H2O![]() NaOH + HCl
NaOH + HCl
科目:高中化学 来源: 题型:
【题目】某种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水![]() 酸性
酸性![]() 中的有机物可用
中的有机物可用![]() 表示
表示![]() 交换膜分别是只允许阴
交换膜分别是只允许阴![]() 阳
阳![]() 离子通过的阴
离子通过的阴![]() 阳
阳![]() 离子交换膜
离子交换膜![]()

下列有关说法中不正确的是![]()
A.电池工作时,电子由a极经导线流向b极
B.交换膜a是阴离子交换膜
C.电极b的反应式:![]()
D.相同时间内![]() 相同状况下
相同状况下![]() 生成
生成![]() 和
和![]() 的体积比为2:5
的体积比为2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将FeCl3饱和溶液煮沸可得到带正电荷的Fe(OH)3胶体
B.0.5 molH2SO4与0.5 molBa(OH)2完全反应所放出的热量即为中和热
C.H2O的沸点高于H2S是因为O-H键的键能大于S-H键的键能
D.向新制氯水中加入CaCO3可使溶液中HClO浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:A.金刚石、B.MgF2、C.NH4Cl、D.固体碘,用序号填写空白:既存在离子键又存在共价键的是______,熔化时不需破坏化学键的是______。
(2)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 molN-N键吸收167 kJ热量,生成1 molN≡N键放出942 kJ热量。根据以上信息和数据,则1molN4完全转化为N2______(填“放出”或“吸收”)热量______kJ。

(3)50 mL 0.50 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在如图2所示的装置中进行中和反应。请回答下列问题:如图,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值______(填“偏大”、“偏小”或“无影响”)。
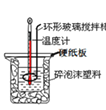
(4)向50mL0.50 mol/L的NaOH溶液中分别加入稀醋酸、稀盐酸、浓硫酸,则恰好完全反应时的放出热量Q1、Q2、Q3从大到小的排序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到某二元弱酸H2A溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )

A.Ka2(H2A)的数量级为10-5B.NaHA溶液中c(H+)>c(OH-)
C.曲线M表示pH与![]() 的变化关系D.当混合溶液呈中性时:c (Na+) > c (HA-) > c (A2-)> c (OH-)=c (H+)
的变化关系D.当混合溶液呈中性时:c (Na+) > c (HA-) > c (A2-)> c (OH-)=c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
编号 | 浓度/(mol·L-1) | 浓度/(mol·L-1) | 液的 pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=11 |
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?___________
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:____________________
(3)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式表示):c(Na+)-c(A-)=______mol·L-1。
(4)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
在0.1 mol·L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1 B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(H+)=c(OH-)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。请回答下列问题:

(1)A点表示Ag2SO4是________(填“饱和”或“不饱和”)溶液。
(2)B点对应的Ksp________(填“>”“<”或“=”)C点对应的Ksp。
(3)现将足量的Ag2SO4分别放入:
A.![]() 溶液
溶液
B.![]() 蒸馏水
蒸馏水
C.![]() 溶液
溶液
则Ag2SO4的溶解程度由大到小的排列顺序为________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25mL 0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2mol·L-1 CH3COOH溶液,溶液的pH变化曲线如图所示,下列分析结论正确的是( )
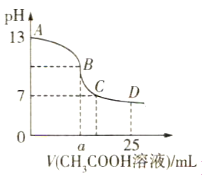
A.若B点的横坐标a=12.5,则有c(Na+)=c(CH3COO-)
B.对曲线上A、B间任意一点,溶液中都有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
D.C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
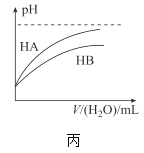
【题目】下列关于各图的叙述正确的是( )



A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,则
发生反应过程中的能量变化,则![]() 的燃烧热为
的燃烧热为![]()
B.乙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
C.丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度的NaA溶液的pH小于同浓度NaB溶液的pH
D.丁表示![]() 溶液滴定
溶液滴定![]() 醋酸溶液得到的滴定曲线
醋酸溶液得到的滴定曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com