
【题目】温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
编号 | 浓度/(mol·L-1) | 浓度/(mol·L-1) | 液的 pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=11 |
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?___________
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:____________________
(3)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式表示):c(Na+)-c(A-)=______mol·L-1。
(4)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
在0.1 mol·L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1 B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(H+)=c(OH-)+c(HB-)
【答案】a=7时,HA是强酸;a>7时,HA是弱酸 c(Na+)>c(A-)>c(OH-)>c(H+) 10-3-10-11 AC
【解析】
(1)等物质的量混合时,二者恰好反应生成盐,根据溶液的pH判断酸性强弱;
(2)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,结合电荷守恒判断;
(3)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+);
(4)根据二元酸的电离方程式知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答.
(1)若HA是强酸,恰好与NaOH溶液反应生成强酸强碱盐,pH=7;若HA是弱酸,生成的NaA水解显碱性,pH>7,故答案为:a=7时,HA是强酸;a>7时,HA是弱酸;
(2)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(3)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+)=(10-3-10-11)molL-1,
故答案为:10-3-10-11;
(4)在Na2B中存在水解平衡:B2-+H2O![]() HB-+OH-,HB-不会进一步水解,所以溶液中没有H2B分子,
HB-+OH-,HB-不会进一步水解,所以溶液中没有H2B分子,
A.由物料守恒得c(B2-)+c(HB-)=0.1molL-1,故A正确;
B.HB-不会进一步水解,所以溶液中没有H2B分子,故B错误;
C.溶液中质子守恒得c(OH-)=c(H+)+c(HB-),故C正确;
D.溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故D错误;
故答案为:AC.


科目:高中化学 来源: 题型:
【题目】下列关系不正确的是( )
A.等质量的烃完全燃烧消耗氧量:甲烷>乙烷>乙烯>苯
B.熔点:正戊烷>2,2–二甲基戊烷>2,3–二甲基丁烷>丙烷
C.密度:CCl4>CH2Cl2>H2O>苯
D.![]() 的一氯取代产物有4种
的一氯取代产物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH和盐酸都是中学化学常见的试剂
(一)某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度
(1)将5.0g烧碱样品( 杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,用________式滴定管量取,下图是某次滴定时的滴定管中的液面,其读数为________ mL。

(2)由下表数据, NaOH的百分含量是________。
滴定次数 | 待测NaOH溶液体积(mL) | 标准盐酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(3)用标准盐酸滴定某浓度的NaOH溶液,下列操作可能使测定结果偏高的是(_____)
A.用蒸馏水洗锥形瓶后,直接取10.00 mL待测液注入锥形瓶中
B.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
D.对酸式滴定管,滴定前正确读数,滴定后俯视读数
(二)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:

(4)从实验装置上看,图中缺少的一种玻璃用品是__________。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将________( 填“偏大”、“偏小”或“无影响”)。
(5)已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:_______________。
(三)常温时,向盛有0.1 mol·L-1Mg2+溶液的试管中滴加适量的NaOH溶液,到pH为11.0时(已知Ksp Mg(OH)2=5.61×1012)
(6)此时上层清液中c(Mg2+)=________ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解化学方程式或水解离子方程式正确的是 ( )
A.NH4+ + H2O = NH3·H2O + H+B.CH3COO— + H2O![]() CH3COOH + OH—
CH3COOH + OH—
C.CH3COOH + NaOH![]() CH3COONa + H2OD.NaCl + H2O
CH3COONa + H2OD.NaCl + H2O![]() NaOH + HCl
NaOH + HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
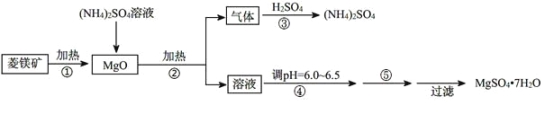
(1)步骤②中发生反应的离子方程式为____________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是___________________________________。
(3)步骤⑤的操作为______________________________
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_____[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:aA(g)+ bB(g)![]() cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
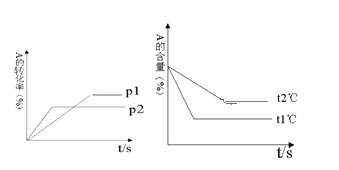
(1)压强p1 _________p2(填“>”或“<”);
(2)a +b__________c +d(填“>”或“<”);
(3)温度t1℃_________t2℃(填“>”或“<”);
(4)正反应为_________反应。(填吸热或放热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5mol/L、MgCO3的饱和溶液中c(Mg2+)为2.6×10-3mol/L.若在5mL浓度均为0.01mol/L的CaCl2和MgCl2溶液中,逐滴加入5mL 0.012mol/LNa2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A. 25℃时,Ksp(CaCO3)=2.8×10-9
B. 加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C. 滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO3-)>c(OH-)
D. 滤液M中: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 加热氯化铁溶液颜色变深
C. 铁在潮湿的环境中生锈 D. 浓硫化钠溶液有臭味
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com