
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
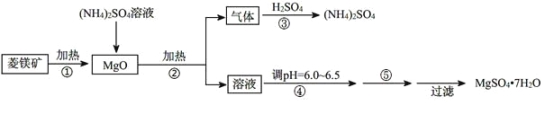
(1)步骤②中发生反应的离子方程式为____________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是___________________________________。
(3)步骤⑤的操作为______________________________
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_____[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
【答案】2NH4++ MgO=Mg2++ 2NH3↑+ H2O 抑制Mg2+水解,以便得到更多更纯的产品 蒸发浓缩,冷却结晶 蓝色
【解析】
(1)MgO与硫酸铵溶液加热反应生成的气体与硫酸反应生成硫酸铵,说明该气体是氨气,则MgO与硫酸铵加热的产物中有氨气,说明MgO的加入,促进铵根离子的水解,生成氨气,得到的氢离子与MgO反应生成镁离子和水,所以步骤②中发生反应的离子方程式为2NH4++ MgO=Mg2++ 2NH3↑+ H2O;
(2)得到的硫酸镁溶液中镁离子水解,得不到较纯的硫酸镁晶体所以为抑制镁离子水解,步骤④中调节pH=6.0~6.5,以便得到更多更纯的产品;
(3)由溶液得到晶体需进行的操作是蒸发浓缩、冷却结晶,所以步骤⑤的操作为蒸发浓缩,冷却结晶;
(4)饱和的氢氧化镁溶液存在Mg(OH)2 (s)= Mg2+(aq) + 2 OH-(aq)溶解平衡,2c(Mg2+)= c(OH -),又溶度积Ksp= c(Mg2+)c2(OH -)=5.6×10-12 ,由此可以得出c(OH -)=2.24×10-4 ,c(H+)=1×10-14/2.24×10-4 =4.5×10-11,所以pH>9.6,所以加入百里酚蓝指示剂,溶液呈蓝色。


科目:高中化学 来源: 题型:
【题目】如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是![]()
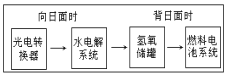
A.该能量转化系统中的水也是可能循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极有![]() 放出
放出
D.燃料电池放电时的负极反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:

下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.由2Cu + O2![]() 2CuO可推出同族的硫也有Cu + S
2CuO可推出同族的硫也有Cu + S![]() CuS
CuS
B.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C.Na能与水反应生成H2,K、Ca也能与水反应生成H2
D.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
编号 | 浓度/(mol·L-1) | 浓度/(mol·L-1) | 液的 pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=11 |
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?___________
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:____________________
(3)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式表示):c(Na+)-c(A-)=______mol·L-1。
(4)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
在0.1 mol·L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1 B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(H+)=c(OH-)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中NO3- 达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3 -的浓度,某兴趣小组提出如下方案:
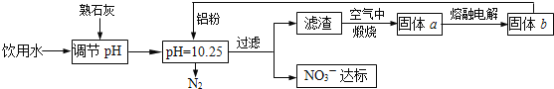
请回答下列问题:
(1)该方案中选用熟石灰调节 pH,理由是_______、__________、________, 在调节pH时,若pH过大或过小都会造成________的利用率降低。
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为____________________________________。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物 均可参与大气循环,则催化还原法的离子方程式为____________________________________。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化 成NO3-。两步反应的能量变化示意图如下:
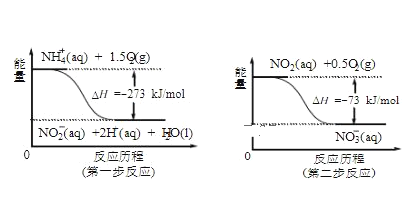
试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL![]() 的醋酸溶液中不断滴入
的醋酸溶液中不断滴入![]() 的NaOH溶液,溶液的pH变化曲线,如图所示,在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是
的NaOH溶液,溶液的pH变化曲线,如图所示,在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是
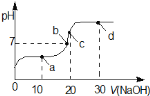
A.a点时:c![]()
![]()
![]()
![]()
![]() (OH-)
(OH-)
B.b点时:c![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
C.c点时:c![]()
![]()
![]()
![]()
![]()
![]()
![]()
D.d点时:c![]()
![]()
![]()
![]()
![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取![]() HY溶液与
HY溶液与![]()
![]() NaOH溶液等体积混合
NaOH溶液等体积混合![]() 忽略溶液体积的变化
忽略溶液体积的变化![]() ,测得混合溶液的
,测得混合溶液的![]() ,则下列说法正确的是
,则下列说法正确的是![]()
A.混合溶液中由水电离出的![]()
B.溶液中离子浓度由大到小的顺序为![]()
C.![]()
![]()
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com