
【题目】饮用水中NO3- 达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3 -的浓度,某兴趣小组提出如下方案:
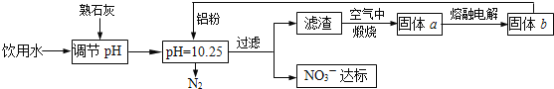
请回答下列问题:
(1)该方案中选用熟石灰调节 pH,理由是_______、__________、________, 在调节pH时,若pH过大或过小都会造成________的利用率降低。
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为____________________________________。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物 均可参与大气循环,则催化还原法的离子方程式为____________________________________。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化 成NO3-。两步反应的能量变化示意图如下:
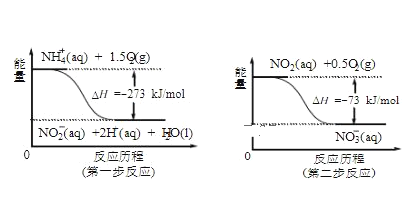
试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
【答案】引入的Ca2+对人体无害 来源丰富 价格便宜(意思相近均给分) 铝(或Al) 10Al+6NO3- +18H2O=10Al(OH)3↓+3N2↑+6OH- 5H2+2NO3-  N2↑+4H2O+2OH- NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ· mol-1
N2↑+4H2O+2OH- NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ· mol-1
【解析】
(1)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应;
(2)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气;
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气;
(4)由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2-(aq)+H2O(l) △H=-2736 kJ·mol-1,第二步热化学反应为NO2-(aq)+0.5O2(g)=NO3-(aq))△H=-73kJ`mol-1,利用盖斯定律可计算1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式。
(1)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应,否则会造成Al的大量消耗,
故答案为:来源丰富、价格便宜;引入的Ca2+对人体无害;铝;
(2)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3-反应的离子方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-,
故答案为:10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
(3)H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-![]() N2+4H2O+2OH-(或5H2+2NO3-+2H+
N2+4H2O+2OH-(或5H2+2NO3-+2H+![]() N2↑+6H2O);
N2↑+6H2O);
(4)由图可知,第一步热化学反应为NH4+(aq)+![]() O2(g)=2H+(aq)+NO2-(aq)+H2O(l) △H=-2736 kJ·mol-1 ①,第二步热化学反应为NO2-(aq)+
O2(g)=2H+(aq)+NO2-(aq)+H2O(l) △H=-2736 kJ·mol-1 ①,第二步热化学反应为NO2-(aq)+![]() O2(g)=NO3-(aq) △H=-73kJ·mol-1 ②,
O2(g)=NO3-(aq) △H=-73kJ·mol-1 ②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l) △H=-346 kJ·mol-1,
故答案为:NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l) △H=-346 kJ·mol-1。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性好的树脂,如图是一种醇酸树脂的合成线路:
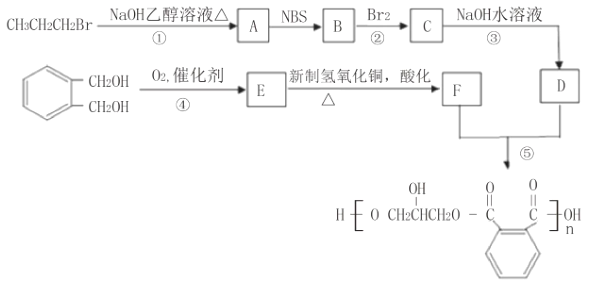
已知:RCH2CH=CH2
RCH2OH![]() R-CHO
R-CHO RCOOH
RCOOH
(1)醇酸树脂中含有的官能团名称为______________。
(2)写出B的结构简式是______________。
(3)反应①~⑤中属于取代反应的是___________(填序号)。
(4)写出由C→D化学方程式_________________________。
(5)与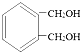 互为同分异构体能同时满足下列条件的共有_________种。
互为同分异构体能同时满足下列条件的共有_________种。
a.苯环上有两个取代基 b.属于酚类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。可通过H2S与CO2在高温下反应制得COS:H2S(g)+CO2(g) ![]() COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
实验 | 温度/℃ | 起始时 | 平衡时 | 平衡 常数 | |||
n(CO2)/mol | n(H2S)/mol | n(COS)/mol | n(H2O)/mol | n(COS)/mol | |||
1 | T1 | 0.200 | 0.200 | 0 | 0 | 0.0200 | K1 |
2 | T2 | 0.200 | 0.200 | 0 | 0 | n2 | K2 =1/36 |
3 | T2 | 0.400 | 0.400 | 0 | 0 | n3 | K3 |
下列判断不正确的是
A. K1=1/81
B. K2 = K3且n3= 2n2
C. 初始反应速率:实验3 gt; 实验2 > 实验1
D. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用离子方程式表示泡沫灭火器的灭火原理:______________
(2)25℃时,Ksp[Fe(OH)3]=2.79×10﹣39,该温度下反应Fe(OH)3+ 3H+ ![]() Fe3++ 3H2O的平衡常数K=_______
Fe3++ 3H2O的平衡常数K=_______
(3)在加热条件下 CeCl3 易发生水解,无水 CeCl3 可用加热 CeCl3·6H2O 和 NH4Cl 固体混合物的方法来制备。其中NH4Cl 的作用是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
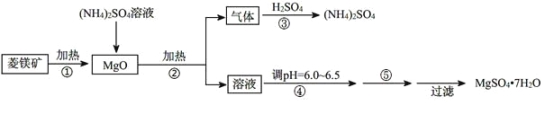
(1)步骤②中发生反应的离子方程式为____________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是___________________________________。
(3)步骤⑤的操作为______________________________
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_____[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向AgCl饱和溶液中加入NaCl固体,c(Cl-)增大,Ksp增大
B.已知![]() 的
的![]() ,则所有含有固体MgCO3的溶液中,都有
,则所有含有固体MgCO3的溶液中,都有![]() ,且
,且![]()
C.可通过比较![]() 和
和![]() 的Ksp的大小比较它们的溶解性
的Ksp的大小比较它们的溶解性
D.25 ℃时![]() ,故新生成的 AgCl可转化为AgI
,故新生成的 AgCl可转化为AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B. pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
C. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) >c(H+)
D. 向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/ c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚是一种重要的清洁燃料.合成二甲醚是解决能源危机的研究方向之一.
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=﹣41.1kJ/mol
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H3=﹣24.5kJ/mol
则反应2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=____________.
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率.利用二甲醚酸性介质燃料电池电解200mL饱和食盐水(惰性电极),电解一段时间后,阴极收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的正极反应式为_____________________________.
②请写出电解食盐水的化学方程式____________________.
③电解后溶液的pH=_________.
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
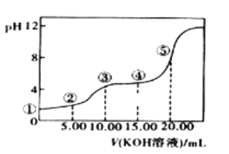
(3)点③所示溶液中所有离子的浓度由大到小的顺序为:___________________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O422-)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com