
【题目】醇酸树脂是一种成膜性好的树脂,如图是一种醇酸树脂的合成线路:
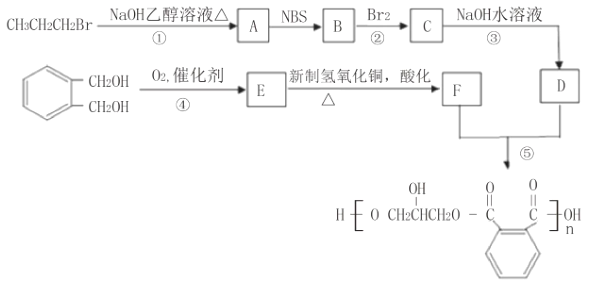
已知:RCH2CH=CH2
RCH2OH![]() R-CHO
R-CHO RCOOH
RCOOH
(1)醇酸树脂中含有的官能团名称为______________。
(2)写出B的结构简式是______________。
(3)反应①~⑤中属于取代反应的是___________(填序号)。
(4)写出由C→D化学方程式_________________________。
(5)与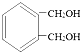 互为同分异构体能同时满足下列条件的共有_________种。
互为同分异构体能同时满足下列条件的共有_________种。
a.苯环上有两个取代基 b.属于酚类
【答案】羟基 酯基 羧基 CH2=CHCH2Br ③⑤ CH2BrCHBrCH2Br+3NaOH→CH2OHCHOHCH2OH+3NaBr 12
【解析】
CH3CH2CH2Br在NaOH乙醇溶液发生消去反应生成A,A为CH3CH=CH2,根据已知信息可判断B为CH2=CHCH2Br,B与溴发生加成生成C,C为CH2BrCHBrCH2Br。C在NaOH水溶液发生水解(取代反应)生成D,D为丙三醇CH2OHCHOHCH2OH。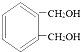 发生催化氧化生成E,E的结构简式为
发生催化氧化生成E,E的结构简式为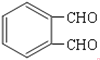 。E被新制氢氧化铜氧化后酸化,生成F,F的结构简式为
。E被新制氢氧化铜氧化后酸化,生成F,F的结构简式为![]() 。
。![]() 和丙三醇发生缩聚反应生成高分子化合物
和丙三醇发生缩聚反应生成高分子化合物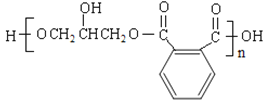 。
。
(1) 中的官能团有:羟基、酯基、羧基;
中的官能团有:羟基、酯基、羧基;
(2)由分析可知B的结构简式是CH2=CHCH2Br;
(3)由分析可知C在NaOH水溶液发生水解生成D,该反应属于取代反应;![]() 和丙三醇发生缩聚反应生成高分子化合物
和丙三醇发生缩聚反应生成高分子化合物 ,缩聚反应本质上也是取代反应;故①~⑤中属于取代反应的是:③⑤;
,缩聚反应本质上也是取代反应;故①~⑤中属于取代反应的是:③⑤;
(4)C在NaOH水溶液发生水解(取代反应)生成D,方程式为:CH2BrCHBrCH2Br+3NaOH→CH2OHCHOHCH2OH+3NaBr;
(5)同分异构体属于苯酚,则苯环上要连接一个羟基,当苯环上有两个邻位取代基时,可能的情况有: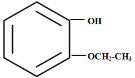 、
、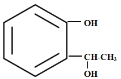 、
、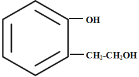 和
和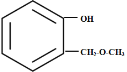 ;同理苯环上有两个对位取代基时或者间位取代基时,各有4种情况,综上所述,满足条件的同分异构体共有12种。
;同理苯环上有两个对位取代基时或者间位取代基时,各有4种情况,综上所述,满足条件的同分异构体共有12种。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
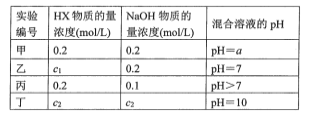
【题目】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a ___7(填“>”“<”或“=”),则HX为强酸;若a ____ 7(填“>”“<”或“=”),则HX为弱酸。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是____。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是___ 酸(填“强”或“弱”)。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=__mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能用勒夏特列原理解释的是( )
A.对于CO(g)+NO2(g)![]() CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
B.氢气和氮气合成氨的反应中,在加压下有利于氨的生成
C.开启可乐瓶,瓶中马上泛起大量气泡
D.利用排液法收集氯气时常用液体为饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断正确的是( )
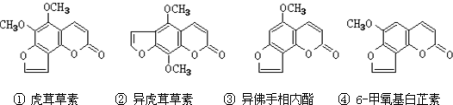
A.②中所含官能团种类比③中多
B.①、④互为同系物
C.①、②、③、④均能使溴水褪色
D.等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是![]()
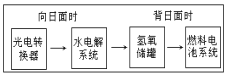
A.该能量转化系统中的水也是可能循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极有![]() 放出
放出
D.燃料电池放电时的负极反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:

该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(气)+3B(气)![]() 2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( )
A. C的生成速率与B的生成速率相等B. A、B、C的浓度不再发生变化
C. A、B、C的分子数之比为1∶3∶2D. 单位时间内消耗nmolA,同时消耗3nmolB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中NO3- 达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3 -的浓度,某兴趣小组提出如下方案:
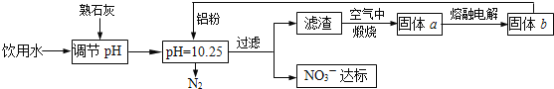
请回答下列问题:
(1)该方案中选用熟石灰调节 pH,理由是_______、__________、________, 在调节pH时,若pH过大或过小都会造成________的利用率降低。
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为____________________________________。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物 均可参与大气循环,则催化还原法的离子方程式为____________________________________。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化 成NO3-。两步反应的能量变化示意图如下:
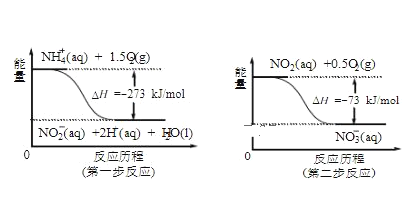
试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com