
【题目】下列说法不能用勒夏特列原理解释的是( )
A.对于CO(g)+NO2(g)![]() CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
B.氢气和氮气合成氨的反应中,在加压下有利于氨的生成
C.开启可乐瓶,瓶中马上泛起大量气泡
D.利用排液法收集氯气时常用液体为饱和食盐水
【答案】A
【解析】
勒夏特列原理的内容是:如改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;研究对象是可逆反应,据此分析。
A. 该反应为等体积反应,增大压强,平衡不移动,不能用勒夏特列原理解释,颜色变深,是由于增大压强,体积减小,NO2浓度变大,A项正确;
B. 氢气和氮气合成氨是可逆反应,增大压强,平衡正向移动,有利于氨的生成,可以用勒夏特列原理解释,B项错误;
C.压强越大,气体的溶解度越大,汽水瓶中存在二氧化碳转变为碳酸的可逆反应,打开瓶盖,压强减小,逆向移动,气体逸出,可以使用勒夏特列原理进行解释,C项错误;
D. 氯气和水反应生成盐酸和次氯酸,是一个可逆反应,饱和食盐水中氯离子浓度大,使得反应难易正向进行,氯气难易溶于饱和食盐水,可排饱和食盐水收集氯气,可以使用勒夏特列原理进行解释,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO3)是工业盐的主要成分,在漂白、电镀等方面应用广泛。己知: 室温下,2NO+Na2O2= =2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(部分夹持装置已略去)下列说法正确的是
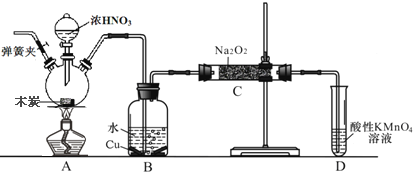
A. 实验开始前先向装置中通入N2,实验结束时先停止通入N2再熄灭酒精灯
B. 可以将B中药品换成NaOH 溶液
C. 应在B、C之间加一个盛放碱石灰的干燥管
D. D装置用于尾气处理,标况下,每吸收11.2L的尾气消耗0.2mol 的高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
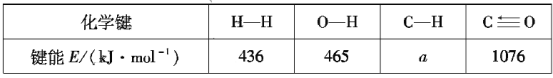
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
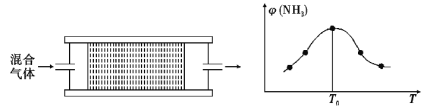
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是

A. 该反应属于化合反应
B. b的二氯代物有6种结构
C. 1mol b加氢生成饱和烃需要6molH2
D. C5H11Cl的结构有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
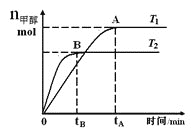
A.平衡常数K=![]()
B.该反应在T1时的平衡常数比T2时的小
C.CO合成甲醇的反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是____________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为_______________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32-(aq)![]() FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:

①溶液E和F分别为____________、__________。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,金属—空气电池的研究和应用取得很大进步,这种新型燃料电池具有比能量高、污染小、应用场合多等多方面优点。铝—空气电池工作原理如图所示。关于金属—空气电池的说法不正确的是( )

A.铝—空气电池(如上图)中,铝作负极,电子通过外电路到正极
B.为帮助电子与空气中的氧气反应,可使用活性炭作正极材料
C.碱性溶液中,负极反应为Al(s)+3OH-(aq)=Al(OH)3(s)+3e-,每消耗2.7 g Al(s),需耗氧6.72 L(标准状况)
D.金属—空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为![]() 、
、![]() ,还含有少量的FeO、
,还含有少量的FeO、![]() 和C等。实验室模拟工业上的两种方法从粉煤灰中提取活性
和C等。实验室模拟工业上的两种方法从粉煤灰中提取活性![]() ,其流程如下:
,其流程如下:
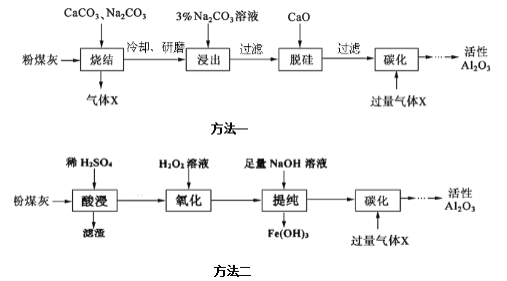
己知“烧结”过程的产物主要是:![]() 、
、![]() 、
、![]() 和
和![]() 等。
等。
![]() “烧结”过程中铝元素转化的化学方程式为__________。
“烧结”过程中铝元素转化的化学方程式为__________。
![]() “浸出”过程中,
“浸出”过程中,![]() 可完全彻底水解,水解反应的离子方程式为________。
可完全彻底水解,水解反应的离子方程式为________。
![]() 滤渣的主要成分是____________。
滤渣的主要成分是____________。
![]() “提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中
“提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中![]() ______ _。
______ _。
![]() “提纯”过程中,如当
“提纯”过程中,如当![]() 时,说明溶液中
时,说明溶液中![]() 被除尽,则此时溶液中pH______。
被除尽,则此时溶液中pH______。![]() 己知
己知![]() 的
的![]()
![]() “碳化”过程中,通入过量气体X时发生反应的离子方程式为________。
“碳化”过程中,通入过量气体X时发生反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com