
【题目】粉煤灰是燃煤电厂的废渣,主要成分为![]() 、
、![]() ,还含有少量的FeO、
,还含有少量的FeO、![]() 和C等。实验室模拟工业上的两种方法从粉煤灰中提取活性
和C等。实验室模拟工业上的两种方法从粉煤灰中提取活性![]() ,其流程如下:
,其流程如下:
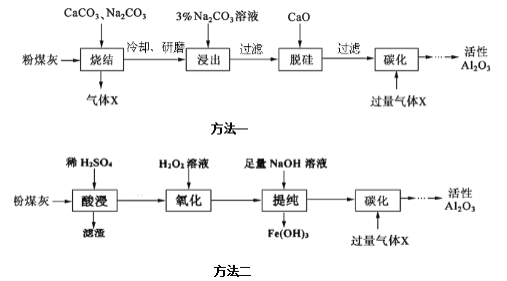
己知“烧结”过程的产物主要是:![]() 、
、![]() 、
、![]() 和
和![]() 等。
等。
![]() “烧结”过程中铝元素转化的化学方程式为__________。
“烧结”过程中铝元素转化的化学方程式为__________。
![]() “浸出”过程中,
“浸出”过程中,![]() 可完全彻底水解,水解反应的离子方程式为________。
可完全彻底水解,水解反应的离子方程式为________。
![]() 滤渣的主要成分是____________。
滤渣的主要成分是____________。
![]() “提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中
“提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中![]() ______ _。
______ _。
![]() “提纯”过程中,如当
“提纯”过程中,如当![]() 时,说明溶液中
时,说明溶液中![]() 被除尽,则此时溶液中pH______。
被除尽,则此时溶液中pH______。![]() 己知
己知![]() 的
的![]()
![]() “碳化”过程中,通入过量气体X时发生反应的离子方程式为________。
“碳化”过程中,通入过量气体X时发生反应的离子方程式为________。
【答案】![]()
![]()
![]() 和C
和C ![]()
![]()
![]()
【解析】
方法一:粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等,当加CaCO3、Na2CO3进行烧结,发生Al2O3+Na2CO3![]() 2NaAlO2+CO2↑、Na2CO3+SiO2
2NaAlO2+CO2↑、Na2CO3+SiO2![]() Na2SiO3+CO2↑、2CaCO3+SiO2
Na2SiO3+CO2↑、2CaCO3+SiO2![]() Ca2SiO4+2CO2↑、Fe2O3+Na2CO3
Ca2SiO4+2CO2↑、Fe2O3+Na2CO3![]() 2NaFeO2+CO2↑、C+O2
2NaFeO2+CO2↑、C+O2![]() CO2,所以气体X为CO2,操作a为冷却、研磨,加入碳酸钠溶液浸出,AlO2-+2H2OAl(OH)3+OH-,碳酸钠溶液呈碱性,抑制偏铝酸根离子的水解,NaFeO2可完全水解,FeO2-+2H2O=Fe(OH)3↓+OH-,操作b过滤出Fe(OH)3、Ca2SiO4,加入氧化钙脱硅,氧化钙和水反应生成氢氧化钙,氢氧化钙和硅酸根离子反应生成硅酸钙沉淀,操作b过滤出硅酸钙沉淀,滤液为NaAlO2,通入二氧化碳,碳酸酸性强于氢氧化铝,所以发生:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,过滤出沉淀氢氧化铝,加热氢氧化铝生成氧化铝和水,电解氧化铝得到铝和氧气。
CO2,所以气体X为CO2,操作a为冷却、研磨,加入碳酸钠溶液浸出,AlO2-+2H2OAl(OH)3+OH-,碳酸钠溶液呈碱性,抑制偏铝酸根离子的水解,NaFeO2可完全水解,FeO2-+2H2O=Fe(OH)3↓+OH-,操作b过滤出Fe(OH)3、Ca2SiO4,加入氧化钙脱硅,氧化钙和水反应生成氢氧化钙,氢氧化钙和硅酸根离子反应生成硅酸钙沉淀,操作b过滤出硅酸钙沉淀,滤液为NaAlO2,通入二氧化碳,碳酸酸性强于氢氧化铝,所以发生:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,过滤出沉淀氢氧化铝,加热氢氧化铝生成氧化铝和水,电解氧化铝得到铝和氧气。
方法二:制备Al2O3的流程:粉煤灰的主要成分为Al2O3和SiO2,(含少量杂质FeO、Fe2O3),加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤渣为SiO2,滤液中含有Al3+、Fe2+、Fe3+,加双氧水,Fe2+被氧化为Fe3+,氢氧化铝为两性物质,加入足量的氢氧化钠Fe3+转化为沉淀,铝离子生成偏铝酸根离子,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,过滤,滤渣为氢氧化铁,在滤液中通入过量的二氧化碳,生成Al(OH)3,过滤、洗涤、干燥、煅烧得到Al2O3。
![]() 依据流程图可知,“烧结”过程中铝元素转化的化学方程式为:
依据流程图可知,“烧结”过程中铝元素转化的化学方程式为:![]() ;
;
![]() “浸出”过程中,由于
“浸出”过程中,由于![]() 是强碱弱酸盐,当
是强碱弱酸盐,当![]() 完全彻底水解,水解反应的离子方程式为:
完全彻底水解,水解反应的离子方程式为:![]() ;
;
![]() 依据流程图可得,滤渣是粉煤灰和稀硫酸反应后的产物,所以滤渣的主要成分是:
依据流程图可得,滤渣是粉煤灰和稀硫酸反应后的产物,所以滤渣的主要成分是:![]() 和C;
和C;
![]() 依据流程图可得,“提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中是硫酸钠溶液,所以
依据流程图可得,“提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中是硫酸钠溶液,所以![]() ;
;
![]() “提纯”过程中,如当
“提纯”过程中,如当![]() 时,说明溶液中
时,说明溶液中![]() 被除尽,依据
被除尽,依据![]() 的
的![]() ,所以
,所以![]() ,则此时溶液中
,则此时溶液中![]() ;
;
![]() 依据流程图可知,“碳化”过程中,通入过量气体X时发生反应的离子方程式为:
依据流程图可知,“碳化”过程中,通入过量气体X时发生反应的离子方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法不能用勒夏特列原理解释的是( )
A.对于CO(g)+NO2(g)![]() CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
B.氢气和氮气合成氨的反应中,在加压下有利于氨的生成
C.开启可乐瓶,瓶中马上泛起大量气泡
D.利用排液法收集氯气时常用液体为饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中不正确的是( )
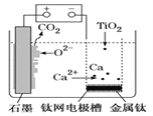
A.由TiO2制得1mol金属Ti,理论上外电路转移4mol电子
B.阳极的电极反应式为C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量会不断减少
D.装置中石墨电极材料需要定期更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g)
2HI(g)
(1)保持容器容积不变,向其中充入1 mol H2,反应速率_____(填“增大”、“减小”或“不变”,下同)。
(2)升高温度,反应速率_____。
(3)扩大容器体积,反应速率_____。
(4)保持容器内气体压强不变,向其中充入1 mol H2(g)和1 mol I2(g),反应速率_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小, Y的次外层电子数是最外层的![]() ,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
A. 原子半径:rW>rZ>rY
B. 化合物ZX中各原子均满足8电子稳定结构
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 简单气态氢化物稳定性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钠都是重要的工业产品。请回答:
(1)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如图所示。
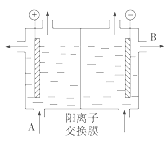
①请写出A、B两处物质的名称或化学式:A__、B__。
②请写出电解食盐水制烧碱的离子方程式__。
(2)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如图。
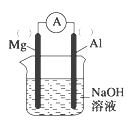
①负极材料为__(填Mg或Al)。
②该原电池的总反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物分子式。
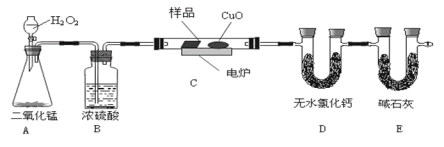
(1)A装置是提供实验所需的O2,C中CuO的作用是__。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为__。
(3)若该有机物的核磁共振氢谱如图所示,峰面积之比为1:3,该化合物的结构简式是:___。
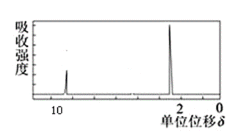
(4)若符合下列条件,则该有机物的结构简式为___。
①环状化合物
②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
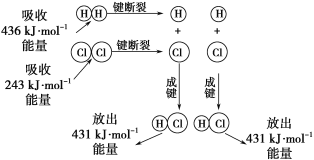
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com