
【题目】铝和氢氧化钠都是重要的工业产品。请回答:
(1)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如图所示。
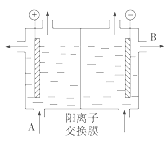
①请写出A、B两处物质的名称或化学式:A__、B__。
②请写出电解食盐水制烧碱的离子方程式__。
(2)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如图。
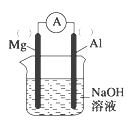
①负极材料为__(填Mg或Al)。
②该原电池的总反应式为__。
【答案】浓NaCl溶液(饱和食盐水也可) 浓NaOH溶液 2Clˉ+2H2O![]() 2OHˉ+H2↑+Cl2↑ Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2OHˉ+H2↑+Cl2↑ Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】
(1)电解饱和食盐水制NaOH阳极氯离子放电生成氯气,阴极水电离出的氢离子放电生成氢气,同时产生氢氧根,据图可知左侧为电解池阳极,所以A应为浓NaCl溶液,钠离子经阳离子交换膜进入阴极,所以B为浓NaOH溶液;
(2)铝可以和NaOH溶液反应,而Mg不行,所以电池总反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
(1)①根据分析可知A为浓NaCl溶液,B为浓NaOH溶液;
②电解食盐水制烧碱的离子方程式为2Clˉ+2H2O![]() 2OHˉ+H2↑+Cl2↑;
2OHˉ+H2↑+Cl2↑;
(2)①电池总反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al失电子被氧化,所以Al为负极;
②电池总反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是我国药学家屠呦呦在1971年发现的一种含有过氧基团的倍半萜内酯的无色针状晶体,不溶于水,易溶于乙醇、石油醚、苯等有机溶剂,熔点为156℃,沸点389.9℃,热稳定性差。一种超声提取青蒿素的主要工艺流程如图:
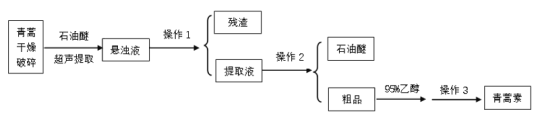
已知:石油醚的沸点为30~80℃,青蒿素在95%乙醇中的溶解度随温度的升高而增大。下列说法不正确的是( )
A.超声提取的原理是在强大的超声波作用下,使青蒿细胞乳化、击碎、扩散,其优点是加速溶解
B.操作1的名称是萃取
C.操作3的步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.操作3中若温度过高,会降低青蒿素的产率,其原因可能是青蒿素热稳定性差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为![]() 、
、![]() ,还含有少量的FeO、
,还含有少量的FeO、![]() 和C等。实验室模拟工业上的两种方法从粉煤灰中提取活性
和C等。实验室模拟工业上的两种方法从粉煤灰中提取活性![]() ,其流程如下:
,其流程如下:
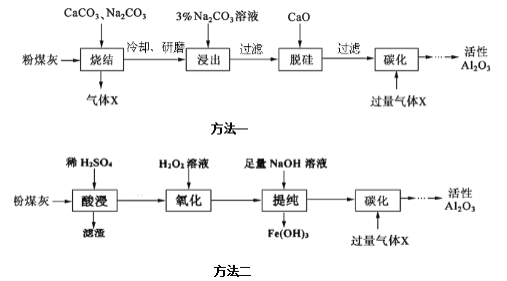
己知“烧结”过程的产物主要是:![]() 、
、![]() 、
、![]() 和
和![]() 等。
等。
![]() “烧结”过程中铝元素转化的化学方程式为__________。
“烧结”过程中铝元素转化的化学方程式为__________。
![]() “浸出”过程中,
“浸出”过程中,![]() 可完全彻底水解,水解反应的离子方程式为________。
可完全彻底水解,水解反应的离子方程式为________。
![]() 滤渣的主要成分是____________。
滤渣的主要成分是____________。
![]() “提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中
“提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中![]() ______ _。
______ _。
![]() “提纯”过程中,如当
“提纯”过程中,如当![]() 时,说明溶液中
时,说明溶液中![]() 被除尽,则此时溶液中pH______。
被除尽,则此时溶液中pH______。![]() 己知
己知![]() 的
的![]()
![]() “碳化”过程中,通入过量气体X时发生反应的离子方程式为________。
“碳化”过程中,通入过量气体X时发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有可逆反应.2NO2(g)![]() N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
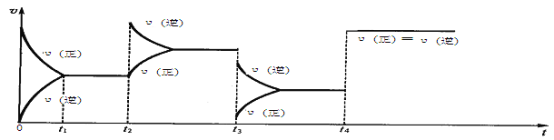
t2:_______________________________________________;
t3:_______________________________________________;
t4:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3已达到平衡状态
2NH3已达到平衡状态
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键形成的同时,有3个N—H键形成
D.1个N≡N键形成的同时,有6个N—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA
B. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
C. 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA
D. 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为___;
H2(g)+I2(g)的平衡常数K2为___;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)C(H2)=c(CO)c(H2O),判断此时温度为___℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 、
、![]() 、
、![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
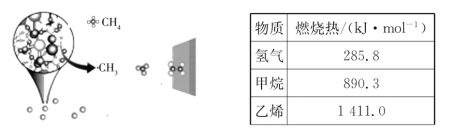
(1)已知相关物质的燃烧热如表所示,写出甲烷制备乙烯的热化学方程式__________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是__________(填结构简式)
(3)在400℃时,向初始体积为1L的恒压密闭反应器中充入1molCH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:
①在该温度下,其平衡常数KC=__________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率__________。(填“增大”“减小”“不变”或“无法确定”),理由是__________。
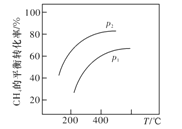
③若反应器的体积固定,不同压强下可得变化如图所示,则压强p1与p2的大小关系是__________。
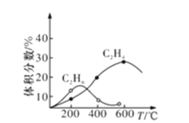
(4)实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是__________。
C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是__________。
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com