
����Ŀ���п�Ժ������ѧ�����о�����һ�����³ɹ�ʵ���˼����Ч������ϩ����ͼ��ʾ�������ڴ����������⣬�ڲ�ͬ�¶��·ֱ��γ�![]() ��
��![]() ��
��![]() �����ɻ����������о����ɻ���CH2ż����Ӧ������ϩ(�÷�Ӧ���̿���)
�����ɻ����������о����ɻ���CH2ż����Ӧ������ϩ(�÷�Ӧ���̿���)
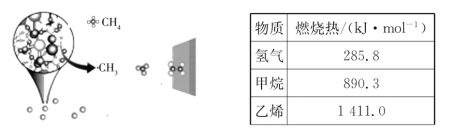
(1)��֪������ʵ�ȼ���������ʾ��д�������Ʊ���ϩ���Ȼ�ѧ����ʽ__________��
(2)�ִ�ʯ�ͻ�������Ag����������ʵ����ϩ�������Ʊ�X(����ʽΪC2H4O������˫��)�÷�Ӧ�����������ԭ�Ӿ��ã���Ӧ������__________(��ṹ��ʽ)
(3)��400��ʱ�����ʼ���Ϊ1L�ĺ�ѹ�ܱշ�Ӧ���г���1molCH4������(1)�з�Ӧ�����ƽ����������C2H4���������Ϊ25.0%����
���ڸ��¶��£���ƽ�ⳣ��KC��__________��
������÷�Ӧ����ͨ�����ˮ����(���μӷ�Ӧ������400��)����C2H4�IJ���__________��(�������С�������䡱����ȷ����)��������__________��
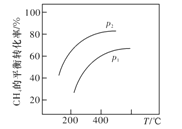
������Ӧ��������̶�����ͬѹǿ�¿ɵñ仯��ͼ��ʾ����ѹǿp1��p2�Ĵ�С��ϵ��__________��
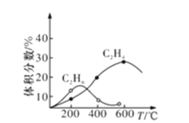
(4)ʵ���Ʊ�C2H4ʱ��ͨ�����ڸ���Ӧ2CH4(g)![]() C2H6(g)��H2(g)����Ӧ����CH4��ʼ�����䣬��ͬ�¶���C2H6��C2H4������������¶ȵĹ�ϵ������ͼ��ʾ�����¶ȸ���600��ʱ���п��ܵõ�һ�ֽ϶��˫̼�л��������������__________��
C2H6(g)��H2(g)����Ӧ����CH4��ʼ�����䣬��ͬ�¶���C2H6��C2H4������������¶ȵĹ�ϵ������ͼ��ʾ�����¶ȸ���600��ʱ���п��ܵõ�һ�ֽ϶��˫̼�л��������������__________��
(5)C2H4��C2H6������Ϊȼ�ϵ�ص�ԭ�ϣ���д��C2H4��NaOH��Һ����ȼ�ϵ�صĸ����ĵ缫��Ӧ����ʽ__________��
���𰸡�2CH4(g)C2H4(g)+2H2(g)��H=+202.0kJ/mol ![]() 1.0 ���� �÷�ӦΪ���������������ȷ�Ӧ��ͨ�����ˮ�����൱�ڼ��ȣ�ͬʱͨ��ˮ��������Ӧ������������൱�ڼ�Сѹǿ����ʹƽ�����ƣ�C2H4�IJ������� p1>p2 ��Ȳ 16OH��+C2H4��12e��=2
1.0 ���� �÷�ӦΪ���������������ȷ�Ӧ��ͨ�����ˮ�����൱�ڼ��ȣ�ͬʱͨ��ˮ��������Ӧ������������൱�ڼ�Сѹǿ����ʹƽ�����ƣ�C2H4�IJ������� p1>p2 ��Ȳ 16OH��+C2H4��12e��=2![]() +10H2O
+10H2O
��������
(1)���ݱ�����������дH2��CH4��C2H4ȼ���ȵ��Ȼ�ѧ����ʽ���ɸ�˹���ɼ��㣻
(2)X�ķ���ʽC2H4O������˫�����жϳ�X�Ľṹ��ʽ��
(3)�ٸ�������ʽ���ƽ����������C2H4���������Ϊ25.0%���㣻
��ͨ�����ˮ�������൱�ڼ��Ⱥͼ�Сѹǿ������(2)�еķ�Ӧ�����ƽ���Ӱ�����ط������
������������̶������ݷ�Ӧ���������ѹǿ��ƽ���Ӱ������жϣ�
(4)��ͼ��֪���¶ȸ���600��ʱ���н϶�����ɻ�![]() ���ɣ�
���ɣ�
(5)ȼ�ϵ���У�ͨ��ȼ�ϵ�һ��Ϊ������ͨ��������һ��Ϊ�������ݴ˷�����д�缫��Ӧ��
(1)���ݱ����������У���H2(g)+![]() O2(g)�TH2O(l)��H1=-285.8kJ/mol��
O2(g)�TH2O(l)��H1=-285.8kJ/mol��
��CH4(g)+2O2(g)=CO2(g)+2H2O(l)��H2=-890.3kJ/mol��
��C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)��H3=-1411.0kJ/mol��
�����Ʊ���ϩ�Ļ�ѧ����ʽΪ��2CH4(g)C2H4(g)+2H2(g)�����ݸ�˹���ɣ�������2-��-����2�õ���2CH4(g)C2H4(g)+2H2(g)��H=2��H2-��H3-2��H1=+202.0kJ/mol��
(2)��������ϩ���������Ʊ�X��X�ķ���ʽC2H4O������˫������Ӧ�����������ԭ�Ӿ��ÿ�֪��X�Ľṹ��ʽΪ![]() ��
��
(3)��400��ʱ����1L�ĺ��ݷ�Ӧ���г���1molCH4������������Ӧ�����ƽ����������C2H4���������Ϊ25.0%����ת���ļ���Ϊx���ɴ˽�����������ʽ��
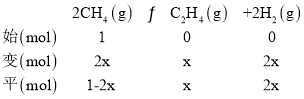
��ͬ���������������ȵ������ʵ���֮�ȣ�������![]() =25%�����x=
=25%�����x=![]() mol��ƽ��ʱ����������ʵ���Ϊ(
mol��ƽ��ʱ����������ʵ���Ϊ(![]() +
+![]() +
+![]() )mol=
)mol=![]() mol��������ѹ������������ʵ���֮�ȵ������֮�ȣ�ԭ���Ϊ1L�����ʱ���ӦΪ
mol��������ѹ������������ʵ���֮�ȵ������֮�ȣ�ԭ���Ϊ1L�����ʱ���ӦΪ![]() L�����Ի�ѧƽ�ⳣ��KC=
L�����Ի�ѧƽ�ⳣ��KC=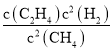 =
= =1.0��
=1.0��
�ڼ����Ʊ���ϩ�ķ�ӦΪ���������������ȷ�Ӧ��ͨ�����ˮ�������൱�ڼ��ȣ�ƽ�����ƣ���������ͬʱͨ��ˮ��������������������൱�ڼ�Сѹǿ��ƽ�����ƣ�����Ҳ�������C2H4�IJ��ʽ�����
������������̶��������Ʊ���ϩ�ķ�ӦΪ�����������ķ�Ӧ���¶���ͬʱ������ѹǿƽ�����淴Ӧ�����ƶ���CH4��ƽ��ת���ʽ��ͣ����p1��p2��
(4)��ͼ��֪�¶ȸ���600��ʱ��Ӧ�н϶�����ɻ�![]() ���ɣ����ɻ��������
���ɣ����ɻ��������![]() ����˫̼�л�������Ϊ��Ȳ��
����˫̼�л�������Ϊ��Ȳ��
(5)ȼ�ϵ��ͨ��ȼ�ϵ�һ��Ϊ�������������ϼ����ߣ�C2H4��NaOH��Һ��ת��ΪCO32-���缫��ӦʽΪ��C2H4-12e-+16OH-=2CO32-+10H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ƶ�����Ҫ�Ĺ�ҵ��Ʒ����ش�
��1�����������ӽ���Ĥ����ⱥ��ʳ��ˮ��NaOH���乤��ԭ����ͼ��ʾ��
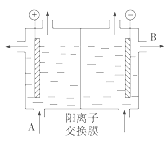
����д��A��B�������ʵ����ƻ�ѧʽ��A__��B__��
����д�����ʳ��ˮ���ռ�����ӷ���ʽ__��
��2����þ������ƬΪ�缫����NaOH��ҺΪ�������Һ��Ƶ�ԭ�����ͼ��
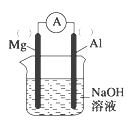
�ٸ�������Ϊ__(��Mg��Al)��
�ڸ�ԭ��ص��ܷ�ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ��(AΪ������)��

�۲쵽����
װ��ͼ1��Cu�缫�ϲ�����������ɫ����
װ��ͼ2��Cu�缫�������ݲ�������Cr�缫�ϲ�����������
������˵����ȷ����
A. ͼ1�ǵ��أ�ͼ2��ԭ���
B. ��������У����Ӿ���Cr�缫����Cu�缫
C. ͼ2��Cr�缫���ܱ�ŨHNO3�ۻ��ɶ��Ե缫
D. ��ʵ�������֪������ԣ�Cu>Cr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
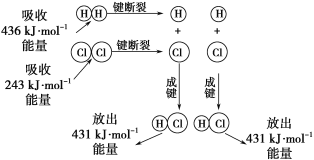
����Ŀ����25�桢101kPa�������£�����1molH��H������436kJ����������1molCl��Cl������243kJ�������γ�1molH-Cl���ų�431 kJ������H2+Cl2=2HCl�Ļ�ѧ��Ӧ������ͼ��ʾ��
��ش������й����⣺
(1)��Ӧ��ϼ����յ�������Ϊ___________________��
(2)������ɼ��ų���������Ϊ______________��
(3)�ж�H2+Cl2=2HCl��Ӧ_____________(���������������ų���)������
(4)��Ӧ���������________(������������=����������)���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������±�飨��Ҫ�ɷ�ΪMgCl2��6H2O������MgSO4.FeCl2�����ʣ��Ʊ�����Mg(ClO3)2��6H2O���������£�
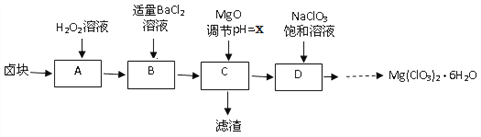

��֪�������ֻ�������ܽ��(S)���¶�(T)�仯������ͼ��ʾ��
������ʱһЩ���ʵ�Ksp���±���
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0��10-16 | 8.0��10-38 | 1.8x10-11 |
��Mg(ClO3)2�н�ǿ�������ԣ��仹ԭ������Cl-.
��1��H2O2�ĵ���ʽΪ_________
��2�������ijɷ���____________���ѧʽ����
��3�����ⶨ��D�������ӵ�Ũ��Ϊ1��10-5 mol/L,��xΪ______
��4��D���������Ļ�ѧ��Ӧ����ʽΪ_____����ͼ����D��......����Mg(ClO3)2��6H2O�����ʵ�鲽������Ϊ���ټ�����������_______���벹�䣩������ȴ�ᾧ���ܹ���ϴ�ӡ�
��5����Ʒ��Mg(ClO3)2��6H2O�����IJⶨ��
����1��ȷ����3.50 g��Ʒ���100 mL��Һ��
����2��ȡ10.00 mL��Һ����ƿ�У�����10.00 mLϡ�����20 .00mL 1.000 mol/L��FeSO4��Һ���ȡ�
����3����ȴ�����£���0.100 mol/L K2Cr2O7��Һ�ζ�ʣ���Fe2�����յ㡣
����4��������2��3�ظ�����
�ٲ���3�з�����Ӧ�����ӷ���ʽ____________
�ڲ���3�����ζ�ǰ���ñ�Һ��ϴ�ζ��ܣ����ᵼ�����ս��_____������ƫ����. ��ƫС����������������
����ƽ������K2Cr2O7��Һ15.00 mL�����Ʒ��Mg(ClO3)2��6H2O����M=299g/mol������������Ϊ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA(g)��B(g) ![]() C(g)��D(g)��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.20 mol A��0.20 mol B,10 sʱ��ƽ�⡣����˵������ȷ����
C(g)��D(g)��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.20 mol A��0.20 mol B,10 sʱ��ƽ�⡣����˵������ȷ����
�¶�/�� | 700 | 830 | 1200 |
Kֵ | 1.7 | 1.0 | 0.4 |
A. �ﵽƽ���B��ת����Ϊ50%
B. ����ѹǿ�������淴Ӧ���ʾ��ӿ�
C. �÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�
D. ��Ӧ��ʼ��ƽ�⣬A��ƽ����Ӧ����v(A)��0.005 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤������������˵����ȷ���ǣ� ��
A.16gO2��O3�Ļ�������к��е�ԭ����ΪNA
B.100g46%���Ҵ�(C2H5OH)��Һ������ԭ����6NA
C.7.8gNa2O2���е�������Ϊ0.4NA
D.0.1molFe������������ȼ�գ�ת�Ƶ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڴ���CuSO4��5H2O�����г���������Fe2+��
�����ᴿʱΪ�˳�ȥFe2+����������ʵ���������ʹFe2+ת��ΪFe3+���������ʿ�������������__(����ĸ)��
A.KMnO4 B.H2O2 C.��ˮ D.HNO3
��Ȼ���ټ����ʵ����ʵ�����ҺpH��4��ʹFe3+ת��ΪFe(OH)3��������ҺpH��ѡ��___(����ĸ)��
A.NaOH B.NH3��H2O C.CuO D.Cu(OH)2
��2����ͬѧ���ɵ�����ҺpH��4�Ƿ��ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ���ͬѧ��Ϊ����ͨ������ȷ�����������й����ϵõ��������ݣ�������Fe(OH)3���ܶȻ�Ksp=1.0��10-38��Cu(OH)2���ܶȻ�Ksp=3.0��10-20��ͨ����������Һ�е�����Ũ��С��1.0��10-5mol��L-1ʱ�ͱ��϶�Ϊ������ȫ������Һ��CuSO4��Ũ��Ϊ3.0mol��L-1����Cu(OH)2��ʼ����ʱ��Һ��pHΪ__��Fe3+��ȫ����[��c(Fe3+)��1.0��10-5mol��L-1]ʱ��Һ��pHΪ__��ͨ������ȷ����������__(����������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڸ�ͼ��������ȷ���ǣ� ��
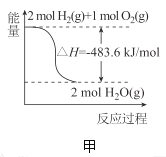
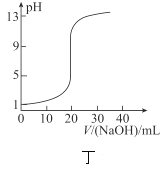
A.�ױ�ʾ![]() ��
��![]() ������Ӧ�����е������仯����
������Ӧ�����е������仯����![]() ��ȼ����Ϊ
��ȼ����Ϊ![]()
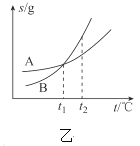
B.�ұ�ʾA��B�����ʵ��ܽ�����¶ȱ仯�������![]() ʱA��B�ı�����Һ�ֱ�������
ʱA��B�ı�����Һ�ֱ�������![]() ʱ�����ʵ���������
ʱ�����ʵ���������![]()
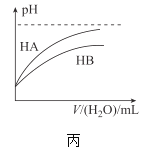
C.����ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯������ͬŨ�ȵ�NaA��Һ��pHС��ͬŨ��NaB��Һ��pH
D.����ʾ![]() ��Һ�ζ�
��Һ�ζ�![]() ������Һ�õ��ĵζ�����
������Һ�õ��ĵζ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com