
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.16gO2与O3的混合气体中含有的原子数为NA
B.100g46%的乙醇(C2H5OH)溶液共含氢原子数6NA
C.7.8gNa2O2含有的离子数为0.4NA
D.0.1molFe在足量氧气中燃烧,转移电子数为0.3NA
【答案】A
【解析】
A.氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为![]() ,故含氧原子为
,故含氧原子为![]() 个,A正确;
个,A正确;
B.乙醇溶液中除了乙醇外,水也含H原子,故![]() 的乙醇溶液中含有的乙醇的质量为46g,物质的量为1mol,故含H原子为6mol,而水的质量=100g-46g=54g,物质的量为3mol,故含H原子为6mol,故共含H原子为
的乙醇溶液中含有的乙醇的质量为46g,物质的量为1mol,故含H原子为6mol,而水的质量=100g-46g=54g,物质的量为3mol,故含H原子为6mol,故共含H原子为![]() 个,B错误;
个,B错误;
C.![]() 过氧化钠的物质的量为
过氧化钠的物质的量为![]() ,而Na2O2由2个钠离子和1个过氧离子构成,故
,而Na2O2由2个钠离子和1个过氧离子构成,故![]() 过氧化钠中含离子为
过氧化钠中含离子为![]() 个,C错误;
个,C错误;
D.铁和氧气中燃烧生成四氧化三铁,平均每个Fe化合价升高了![]() ,1molFe反应电子转移
,1molFe反应电子转移![]() mol电子,故
mol电子,故![]() 铁反应后转移电子数=
铁反应后转移电子数=![]() ,D错误。
,D错误。
答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA
B. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
C. 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA
D. 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究石蜡油裂解产物,设计如图实验。下列说法正确的是
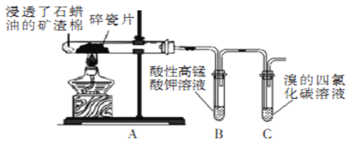
A.实验完毕后先熄灭酒精灯后拆导管
B.两支试管中发生的反应类型相同
C.可观察到B和C试管中液体褪色和分层
D.本实验能证明其产物含有碳碳不饱和键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 、
、![]() 、
、![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
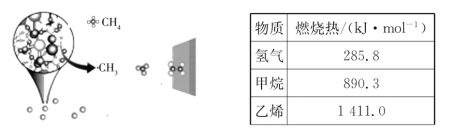
(1)已知相关物质的燃烧热如表所示,写出甲烷制备乙烯的热化学方程式__________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是__________(填结构简式)
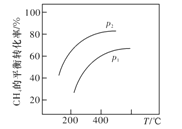
(3)在400℃时,向初始体积为1L的恒压密闭反应器中充入1molCH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:
①在该温度下,其平衡常数KC=__________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率__________。(填“增大”“减小”“不变”或“无法确定”),理由是__________。
③若反应器的体积固定,不同压强下可得变化如图所示,则压强p1与p2的大小关系是__________。
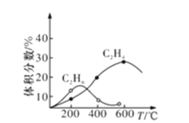
(4)实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是__________。
C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是__________。
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
化学式 | 熔点/℃ | 沸点/℃ | 物理性质 |
COCl2 | -118 | 8.2 | 微溶于水,溶于芳烃、苯、四氯化碳、氯仿、乙酸等多数有机溶剂,遇水迅速水解,生成氯化氢 |
SO3 | 16.8 | 44.8 | 溶于水,并与水反应生成硫酸和放出大量的热 |
SO2Cl2 | -54.1 | 69.1 | 溶于乙酸、苯,与水反应生成H2SO4和HCl |
CCl4 | -22.9 | 76.8 | 微溶于水,易溶于多数有机溶剂 |
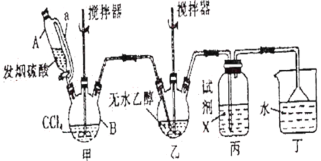
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是__________。
②仪器A的侧导管a的作用是__________。
(2)试剂X是__________,其作用是__________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是__________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:__________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是__________(三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中充入CO2与H2进行反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
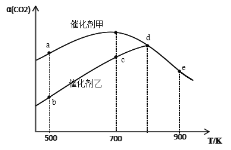
下列叙述正确的是
A. 该可逆反应的ΔH>0
B. 催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能大
C. 500K下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率高
D. d、e两点反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠碱循环法可脱除烟气中的SO2.在钠碱循环中,吸收液为Na2SO3溶液,当吸收液的pH降为6左右时,可采用三室膜电解技术使其再生,图为再生示意图。下列说法正确的是( )
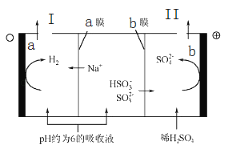
A.a极为电池的阳极
B.a极区吸收液再生的原理是HSO3﹣+H+═H2O+SO2↑
C.b电极的电极反应式是HSO3﹣﹣2e﹣+H2O═SO42﹣+3H+
D.b膜为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220 kJ·mol-1
试回答下列问题:
(1)H2的燃烧热为______,C3H8的燃烧热为________。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧所释放的热量为________。
(3)现有H2和C3H8的混合气体共1 mol,完全燃烧时放出的热量为769.4 kJ,则在混合气体中H2和C3H8的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com