
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3已达到平衡状态
2NH3已达到平衡状态
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键形成的同时,有3个N—H键形成
D.1个N≡N键形成的同时,有6个N—H键断裂
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小, Y的次外层电子数是最外层的![]() ,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
A. 原子半径:rW>rZ>rY
B. 化合物ZX中各原子均满足8电子稳定结构
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 简单气态氢化物稳定性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钠都是重要的工业产品。请回答:
(1)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如图所示。
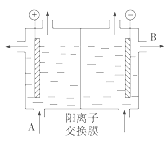
①请写出A、B两处物质的名称或化学式:A__、B__。
②请写出电解食盐水制烧碱的离子方程式__。
(2)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如图。
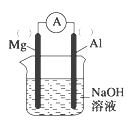
①负极材料为__(填Mg或Al)。
②该原电池的总反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H=+QkJmol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
Si(s)+4HCl(g);△H=+QkJmol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强则化学反应速率降低
B.若反应开始时 SiCl4 为 1mol,则达到平衡时,吸收热量为 QkJ
C.反应至 4min 时,若HCl的浓度为 0.12molL-1,则 H2 的反应速率为 0.03mol/(Lmin)
D.当反应吸收热量为 0.025QkJ 时,生成的 HCl 通入 100mL1molL-1 的 NaOH 恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物分子式。
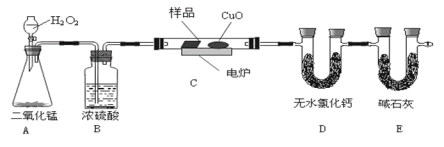
(1)A装置是提供实验所需的O2,C中CuO的作用是__。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为__。
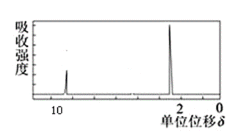
(3)若该有机物的核磁共振氢谱如图所示,峰面积之比为1:3,该化合物的结构简式是:___。
(4)若符合下列条件,则该有机物的结构简式为___。
①环状化合物
②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇的化学方程式为:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
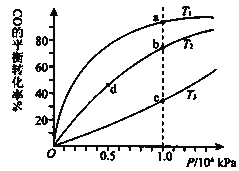
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com