
【题目】可逆反应:aA(g)+ bB(g)![]() cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
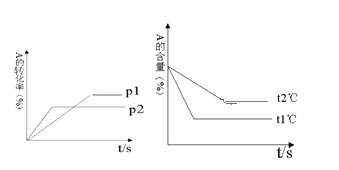
(1)压强p1 _________p2(填“>”或“<”);
(2)a +b__________c +d(填“>”或“<”);
(3)温度t1℃_________t2℃(填“>”或“<”);
(4)正反应为_________反应。(填吸热或放热)
【答案】p1<p2 (a +b)<(c +d) t1℃>t2℃ 吸热
【解析】
根据“先拐先平”判断:p2>p1,t1>t2。p2>p1,增大压强,A的转化率减小,说明增大压强平衡向逆反应方向移动;t1>t2,温度升高,A的百分含量减小,说明平衡正向移动,△H>0。
(1)由图像可知时p2先达到平衡,说明p2压强较大,反应速率较大,则压强 p1比p2小,故答案为:p1<p2;
(2)增大压强,A的转化率减小,说明增大压强平衡向逆反应方向移动,则(a+b)比(c+d)小,故答案为:a +b<c +d;
(3)由图象可知t1℃时先达到平衡,温度较高,则温度t1℃比t2℃高,故答案为:t1℃>t2℃;
(4)温度升高,A的百分含量减小,说明平衡正向移动,升高温度,平衡向吸热反应方向移动,故答案为:吸热。


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定量混合气体发生下列反应:aA(g) + bB(g) ![]() cC(g) + dD(g) ,达到平衡后,测得C气体的浓度为0.5mol/L。恒温下,将密闭容器的体积缩小为1/2 ,再达平衡时,测得C气体的浓度为0.9mol/L。则下列叙述正确的是
cC(g) + dD(g) ,达到平衡后,测得C气体的浓度为0.5mol/L。恒温下,将密闭容器的体积缩小为1/2 ,再达平衡时,测得C气体的浓度为0.9mol/L。则下列叙述正确的是
A. C的体积分数增大B. 平衡向右移动
C. B的转化率提高D. a+b < c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:A.金刚石、B.MgF2、C.NH4Cl、D.固体碘,用序号填写空白:既存在离子键又存在共价键的是______,熔化时不需破坏化学键的是______。
(2)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 molN-N键吸收167 kJ热量,生成1 molN≡N键放出942 kJ热量。根据以上信息和数据,则1molN4完全转化为N2______(填“放出”或“吸收”)热量______kJ。

(3)50 mL 0.50 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在如图2所示的装置中进行中和反应。请回答下列问题:如图,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值______(填“偏大”、“偏小”或“无影响”)。
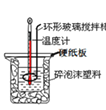
(4)向50mL0.50 mol/L的NaOH溶液中分别加入稀醋酸、稀盐酸、浓硫酸,则恰好完全反应时的放出热量Q1、Q2、Q3从大到小的排序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
编号 | 浓度/(mol·L-1) | 浓度/(mol·L-1) | 液的 pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=11 |
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?___________
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:____________________
(3)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式表示):c(Na+)-c(A-)=______mol·L-1。
(4)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
在0.1 mol·L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1 B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(H+)=c(OH-)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。请回答下列问题:

(1)A点表示Ag2SO4是________(填“饱和”或“不饱和”)溶液。
(2)B点对应的Ksp________(填“>”“<”或“=”)C点对应的Ksp。
(3)现将足量的Ag2SO4分别放入:
A.![]() 溶液
溶液
B.![]() 蒸馏水
蒸馏水
C.![]() 溶液
溶液
则Ag2SO4的溶解程度由大到小的排列顺序为________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL![]() 的醋酸溶液中不断滴入
的醋酸溶液中不断滴入![]() 的NaOH溶液,溶液的pH变化曲线,如图所示,在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是
的NaOH溶液,溶液的pH变化曲线,如图所示,在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是
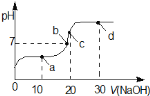
A.a点时:c![]()
![]()
![]()
![]()
![]() (OH-)
(OH-)
B.b点时:c![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
C.c点时:c![]()
![]()
![]()
![]()
![]()
![]()
![]()
D.d点时:c![]()
![]()
![]()
![]()
![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25mL 0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2mol·L-1 CH3COOH溶液,溶液的pH变化曲线如图所示,下列分析结论正确的是( )
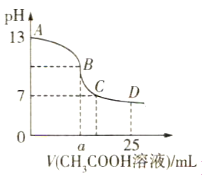
A.若B点的横坐标a=12.5,则有c(Na+)=c(CH3COO-)
B.对曲线上A、B间任意一点,溶液中都有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
D.C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的工业原料,利用甲醇可以制氢气.
Ⅰ.甲醇与水蒸气反应可以直接制得氢气.
已知CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H>0,一定条件下,向体积为2L的恒容器密闭容器中充入1.2molCH3OH(g)和2.8molH2O(g),实验测得,反应共吸收的能量和甲醇的体积分数随时间变化的曲线图象如图1.
CO2(g)+3H2(g)△H>0,一定条件下,向体积为2L的恒容器密闭容器中充入1.2molCH3OH(g)和2.8molH2O(g),实验测得,反应共吸收的能量和甲醇的体积分数随时间变化的曲线图象如图1.
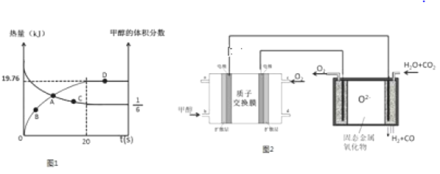
(1)从反应开始至平衡,H2的平均反应速率为___________.
(2)该条件下,CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的△H=__________,该反应的平衡常数为__________.
CO2(g)+3H2(g)的△H=__________,该反应的平衡常数为__________.
(3)在D点时,将容器的体积压缩为原来的一半,同时再充入7.2mol的H2O(g),CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)平衡_________________移动(填“往左”、“往右”或“不”).
CO2(g)+3H2(g)平衡_________________移动(填“往左”、“往右”或“不”).
Ⅱ.将甲醇燃料电池高温电解等物质的量的H2O﹣CO2混合气体可以间接制备H2.其基本原理如图2所示.
(4)甲醇燃料电池以酸性溶液为电解质,写出电池负极的电极反应式_________.
(5)电解池中发生的总反应方程式为_________________.
(6)当质子交换膜中通过的H+数目为4.816×1023时,理论上电解池中产生的H2为_______________L(标准状况).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 的名称为2-乙基丁烷
的名称为2-乙基丁烷
B.35Cl和37Cl 互为同素异形体
C.![]() 经催化加氢后能生成2-甲基戊烷
经催化加氢后能生成2-甲基戊烷
D.CH3CH2COOH和HCOOCH3互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com