
【题目】下列说法正确的是
A.![]() 的名称为2-乙基丁烷
的名称为2-乙基丁烷
B.35Cl和37Cl 互为同素异形体
C.![]() 经催化加氢后能生成2-甲基戊烷
经催化加氢后能生成2-甲基戊烷
D.CH3CH2COOH和HCOOCH3互为同系物
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组以苯胺为原料,按以下反应原理和流程合成对氨基苯磺酸
![]() +H2SO4
+H2SO4 ![]()
![]() +H2O
+H2O
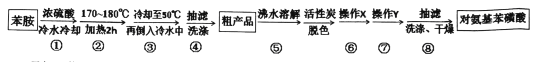
已知:苯胺是一种无色油状液体,微溶于水,易溶于乙醇,熔点-6.1℃,沸点184.4℃。对氨基苯磺酸是一种白色晶体,微溶于冷水,可溶于沸水,易溶于碱性溶液,不溶于乙醇。
(1)下列操作或描述不正确的是________
A.步骤①浓硫酸要分批滴加且不断振荡,并在冰水中冷却目的是为防止苯胺的挥发或碳化
B.步骤③倒入冷水中后,若没有析出晶体,可用玻璃棒搅拌或加入晶种促进晶体析出
C.步骤②加热采用水浴加热,其优点是反应物受热均匀,便于控制温度
D.实验装置中温度计可以改变位置,也可使其水银球浸入在浴液中
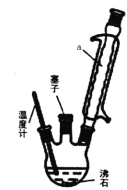
(2)步骤②反应时如图所示装置中进行,其中仪器a的名称_________ 。步骤④中洗涤剂最好选择 ______ 洗涤沉淀的操作是______________。
A. 15%的乙醇 B.热水 C. 冷水 D.NaOH溶液
(3)苯胺与足量浓硫酸反应后,为验证苯胺是否完全反应,可取出几滴反应混合液滴到5-6mL10% NaOH溶液,若 _________现象则认为反应已基本完全。
(4)步骤⑥中操作X为__________,实验有时需要将步骤⑤、⑦、⑧的操作重复多次,其目的是______________________。
(5)苯胺与浓硫酸混合时会反生副反应产生盐类物质,写出其反应化学方程式____。
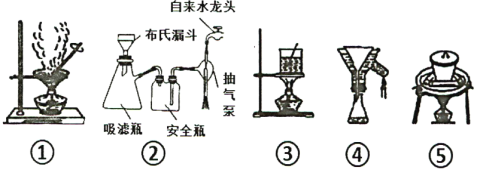
(6)步骤⑤至⑧过程 ,下列装置肯定用不到的是___ ,若制得的晶体颗粒较小,分析可能的原因______(写出两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葛根素(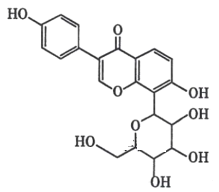 )的说法,正确的是
)的说法,正确的是
A.0.1 mol 葛根素完全燃烧,生成 22.4L(标准状况)H2O
B.1mol 葛根素与溴水反应,最多消耗 2.5mol Br2
C.一定条件下,葛根素能发生氧化、消去及水解等反应
D.与足量 H2 发生加成反应,该分子中官能团的种类减少 2 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
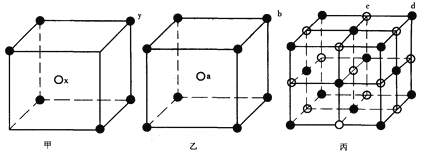
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以异丙苯为起始原料,按下列路线合成植物香料花青醛。

已知:(l)RX![]() RMgX
RMgX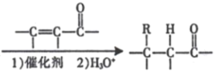 ( R 表示烃基);
( R 表示烃基);
(2)RCHO + R'CH2CHO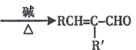 (R、R' 表示烃基或氢原子)。
(R、R' 表示烃基或氢原子)。
请回答:
(1)下列说法正确的是__________(填序号)。
A.异丙苯到化合物C 共经历了三步取代反应
B.常温常压下,化合物D可溶于NaOH 溶液
C.化合物B具有弱碱性
D.花青醛的分子式是C13H18O
(2)写出化合物E的结构简式___________。
(3)写出反应①的化学方程式___________。
(4)设计从乙烯到F 的合成路线(用流程图表示,无机试剂任选)_______。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式______。1H-NMR谱和IR谱检测表明:
①分子中共有4种氢原子,有氮氢键;
②除苯环外不含其它环状结构,且无氮氧键、碳氮双键和氧氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列有关NA的说法正确的是( )
A.28g乙烯与丙烯的混合气体中含有4NA个C-H键
B.标准状况下,3.36LNO2中氧原子数目为0.3NA
C.1L1mol·L-1的CH3COOH溶液与1L0.5mol·L-1的NaOH溶液混合后,CH3COO-的数目为0.5NA
D.理论上,149gNaClO与足量KI溶液反应可得到NA个碘分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+l0CO2↑+8H2O 反应速率的影响因素,有关实验数据如下表所示:
编号 | 温度 ℃ | 催化 剂(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪 色平均时间(min) | ||
体积(mL) | 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.a<12.7,b>6.7
B.可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
C.用H2C2O4表示该反应速率,v(实验1)约为6.6×l0-3 mol·L-1·min-1
D.用KMnO4表示该反应速率,v(实验3)>v(实验1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的综合利用是一个减少污染、提高燃料利用率的重要课题,其常用的方法包括煤的气化、液化以及转化为有机产品等。请回答下列问题:
(1)已知:I.C(s)、CO(g)、H2(g)的燃烧热依次为△H1=-393.5kJ·mol-1、△H2=-283.0kJ·mol-1、△H3=-285.8kJ·mol-1
II.H2O(l)=H2O(g)△H4=+44.0kJ·mol-1
则煤气化主要反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=___。
CO(g)+H2(g)的△H=___。
(2)现在一恒温的刚性容器中加入足量煤,并通入1mol水蒸气,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
①气体的密度保持不变;②断裂2molH-O键的同时生成1molH-H键;③CO的体积分数保持不变;④气体的平均摩尔质量不变;⑤CO与H2的比例保持不变;⑥容器的压强保持不变。
(3)气化后,将水煤气CO与H2化合CO(g)+2H2(g)![]() CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
(4)关于CO(g)+2H2(g)![]() CH3OH(g),下列说法正确的是___(填字母)。
CH3OH(g),下列说法正确的是___(填字母)。
A.加压有利于速率加快和平衡向正反应方向移动
B.甲醇的平衡体积分数随着CO与H2投料比的增大而增大
C.使用催化性能好的催化剂,可提高H2的平衡转化率
D.在恒温恒容条件下达到平衡后,通入Ar,平衡向逆反应方向移动
E.已知E[CO(g)+2H2(g)]>E[CH3OH(g)](E表示物质的能量),则降温有利于提高正反应进行的程度
(5)在一特殊的恒容容器中,充入一定量的CO(g)与H2(g)来模拟CO(g)+2H2(g)![]() CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
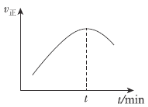
(6)煤经过一系列转化还可得到草酸。常温下,向某浓度的草酸溶液中加入一定量某浓度的NaOH溶液,所得溶液中c(HC2O4-)=c(C2O42-),则此时溶液的pH=___(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭恒温容器中进行下列反应:aA(g)![]() bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
A.化学计量数a>b
B.容器容积增大,平衡向逆反应方向移动
C.容器容积增大,生成物B的质量分数增大
D.该反应的正反应放出热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com