
【题目】密闭恒温容器中进行下列反应:aA(g)![]() bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
A.化学计量数a>b
B.容器容积增大,平衡向逆反应方向移动
C.容器容积增大,生成物B的质量分数增大
D.该反应的正反应放出热量
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 的名称为2-乙基丁烷
的名称为2-乙基丁烷
B.35Cl和37Cl 互为同素异形体
C.![]() 经催化加氢后能生成2-甲基戊烷
经催化加氢后能生成2-甲基戊烷
D.CH3CH2COOH和HCOOCH3互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
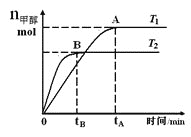
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
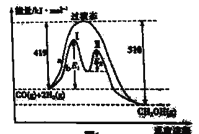
A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_______(填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=_____kPa/min;该温度下反应的平衡常数Kp=______。(分压=总压×物质的量分数)。
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____ K(L); 压强:p(M)__2p(L)。(填“>”“<”或“=”)

(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯(![]() )。电解时,阴极的电极反应式是_________。
)。电解时,阴极的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2CO3样品中含Na2CO3、KNO3、Ba(NO3)2中的一或二种杂质.将13.8 g该样品溶于足量水中得到澄清溶液,再加入过量CaCl2溶液,可得9.0 g沉淀,则原样品中含有的杂质会是
A.肯定没有Na2CO3,Ba(NO3)2
B.肯定有Na2CO3,没有Ba(NO3)2
C.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
D.无法判断何种为肯定或否定的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,其中A着火只能用干燥的沙土灭火,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。

(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________。若生成3mol的B,则转移的电子数目为_______________ 。
(3)写出E与C、D反应生成的B和F离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A.向 CH2BrCOOH中加入足量的氢氧化钠溶液并加热:![]()
B.用氢氧化钠溶液除去铝片表面的氧化膜:Al3++4OH-→AlO2-+2H2O
C.次氯酸钠溶液中通入少量的CO2气体:ClO-+CO2+H2O→HClO+HCO3-
D.等体积、等浓度的Ca(HCO)2溶液和NaOH溶液混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25oC时,浓度均为0.1 mol·L–1的几种溶液的pH如下:
溶液 | ①CH3COONa溶液 | ②NaHCO3溶液 | ③CH3COONH4溶液 |
pH | 8.88 | 8.33 | 7.00 |
下列说法不正确的是
A.①中, c(Na+) = c(CH3COO–) + c( CH3COOH)
B.由①②可知,CH3COO–的水解程度大于![]() 的水解程度
的水解程度
C.③中,c(CH3COO–) = c(NH4+) < 0.1 mol·L–1
D.推测25oC,0.1 mol·L–1 NH4HCO3溶液的pH <8.33
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com