
【题目】煤的综合利用是一个减少污染、提高燃料利用率的重要课题,其常用的方法包括煤的气化、液化以及转化为有机产品等。请回答下列问题:
(1)已知:I.C(s)、CO(g)、H2(g)的燃烧热依次为△H1=-393.5kJ·mol-1、△H2=-283.0kJ·mol-1、△H3=-285.8kJ·mol-1
II.H2O(l)=H2O(g)△H4=+44.0kJ·mol-1
则煤气化主要反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=___。
CO(g)+H2(g)的△H=___。
(2)现在一恒温的刚性容器中加入足量煤,并通入1mol水蒸气,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
①气体的密度保持不变;②断裂2molH-O键的同时生成1molH-H键;③CO的体积分数保持不变;④气体的平均摩尔质量不变;⑤CO与H2的比例保持不变;⑥容器的压强保持不变。
(3)气化后,将水煤气CO与H2化合CO(g)+2H2(g)![]() CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
(4)关于CO(g)+2H2(g)![]() CH3OH(g),下列说法正确的是___(填字母)。
CH3OH(g),下列说法正确的是___(填字母)。
A.加压有利于速率加快和平衡向正反应方向移动
B.甲醇的平衡体积分数随着CO与H2投料比的增大而增大
C.使用催化性能好的催化剂,可提高H2的平衡转化率
D.在恒温恒容条件下达到平衡后,通入Ar,平衡向逆反应方向移动
E.已知E[CO(g)+2H2(g)]>E[CH3OH(g)](E表示物质的能量),则降温有利于提高正反应进行的程度
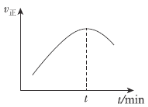
(5)在一特殊的恒容容器中,充入一定量的CO(g)与H2(g)来模拟CO(g)+2H2(g)![]() CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
(6)煤经过一系列转化还可得到草酸。常温下,向某浓度的草酸溶液中加入一定量某浓度的NaOH溶液,所得溶液中c(HC2O4-)=c(C2O42-),则此时溶液的pH=___(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)。
【答案】+131.3 kJ·mol-1 ①③④⑥ 2.5 大于 AE 容器为绝热体系,反应正向进行时放出热量,其影响大于浓度减小的影响,整体反应速率逐渐增大 随着反应进行,浓度减小的影响大于反应放热的影响,整体反应速率逐渐减小 4.2
【解析】
(1)根据C(s)、CO(g)、H2(g)的燃烧热可得:
①C(s)+O2(g)=CO2(g)△H1=-393.5 kJ/mol;
②CO(g)+![]() O2(g)=CO2(g)△H2=-283.0 kJ/mol;
O2(g)=CO2(g)△H2=-283.0 kJ/mol;
③H2(g)+![]() O2(g)=H2O(g)△H3=-285.8kJ/mol;
O2(g)=H2O(g)△H3=-285.8kJ/mol;
又有④H2O(l)=H2O(g)△H4=+44.0kJ·mol-1
根据盖斯定律,①-②-③-④得C(s)+H2O(g)![]() CO(g)+H2(g)的△H=△H1-△H2-△H3- H4=+131.3 kJ·mol-1;
CO(g)+H2(g)的△H=△H1-△H2-△H3- H4=+131.3 kJ·mol-1;
(2)①反应物中有固体,平衡正向移动时气体的质量会变大,容器体积不变,所以气体的密度会发生改变,所以当密度不变时可以说明反应达到平衡,故正确;
②无论反应是否平衡,断裂2molH-O键即有1molH2O参与反应时,一定生成1mol氢气,即生成1molH-H键,故错误;
③平衡移动时CO的体积分数会发生改变,所以当CO的体积分数不变时说明反应已达到平衡,故正确;
④可用极性法考虑,反应未进行时,气体平均摩尔质量为水蒸气的相对分子质量,若完全进行则为CO和H2的平均相对分子质量,即反应进行过程中气体的平均摩尔质量会发生改变,当其不变时说明反应达到平衡,故正确;
⑤初始投料为足量煤和1mol水蒸气,则任意时刻CO与H2的比例均为1:1,故错误;
⑥反应容器容积不变,反应前后气体系数之和不同,所以未达平衡时容器内压强会发生变化,当压强不变时说明反应达到平衡,故正确;
综上所述选:①③④⑥;
(3)反应达到平衡时v正=v逆,即k正·c(CO)·c2(H2)=
k逆·c(CH3OH),反应平衡常数K=![]() ,所以K=
,所以K=![]() =2.5;向体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,此时容器内c(CH3OH)=2.5mol/L,c(CO)=1.5mol/L,c(H2)=1mol/L,则Qc=
=2.5;向体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,此时容器内c(CH3OH)=2.5mol/L,c(CO)=1.5mol/L,c(H2)=1mol/L,则Qc=![]() ,所以此时平衡正向移动,即v正>v逆;
,所以此时平衡正向移动,即v正>v逆;
(4)A.反应特点为前后气体系数不等,且前面气体系数大于后面,加压有利于速率加快和平衡向正反应方向移动,A项正确;
B.甲醇的平衡体积分数随着CO与H2投料比的增大先增大后减小,在CO与H2投料比为
1: 2时取得最大值,B项错误;
C.使用催化剂可降低反应活化能,加快反应速率,但不影响平衡,不能改变H2的平衡转化率,C项错误;
D.在恒温恒容条件下达到平衡后,通入Ar,反应物生成物浓度都不变,平衡不移动,D项错误;
E.已知E[CO(g)+2H2(g)]>E[CH3OH(g)],说明正反应放热,降温有利于提高正反应的程度,E项正确;
综上所述选AE;
(5)容器为绝热体系,反应正向进行时放出热量,其影响大于浓度减小的影响,整体反应速率逐渐增大;随着反应进行,浓度减小的影响大于反应放热的影响,整体反应速率逐渐减小;
(6)草酸第二步电离平衡常数Ka2=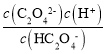 =6×10-5,溶液中c(HC2O4-)=c(C2O42-),则溶液中c(H+)=6×10-5mol/L,又已知lg6=0.8,所以-lg(6×10-5)=4.2,即pH=4.2。
=6×10-5,溶液中c(HC2O4-)=c(C2O42-),则溶液中c(H+)=6×10-5mol/L,又已知lg6=0.8,所以-lg(6×10-5)=4.2,即pH=4.2。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】PBAT(聚己二酸对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物PBA和PBT共聚制得,一种合成路线如下:
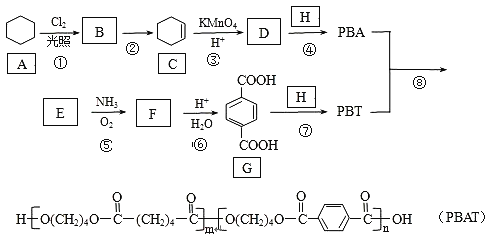
已知:R—CH3![]() R—CN
R—CN![]() R—COOH
R—COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
回答下列问题:
(1)G的官能团的名称为________。
(2)①的反应类型为___________;反应②所需的试剂和条件是___________。
(3)D的结构简式为___________;H的化学名称为___________。
(4)⑤的化学方程式为______________。
(5)M与G互为同系物,M的相对分子质量比G大14;N是M的同分异构体,写出同时满足以下条件的N的结构简式:___________(写两种,不考虑立体异构)。
Ⅰ、既能与FeCl3发生显色反应,又能发水解反应和银镜反应;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1。
(6)设计由丙烯为起始原料制备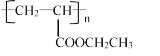 的单体的合成路线(其它试剂可任选)____________。
的单体的合成路线(其它试剂可任选)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 的名称为2-乙基丁烷
的名称为2-乙基丁烷
B.35Cl和37Cl 互为同素异形体
C.![]() 经催化加氢后能生成2-甲基戊烷
经催化加氢后能生成2-甲基戊烷
D.CH3CH2COOH和HCOOCH3互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z。下列说法中正确的是( )
A. Z是共价化合物
B. Z可表示为M2Y
C. Z的电子式可表示为 ![]()
D. M形成+2价阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学采用萃取—分液的方法从碘水中提取碘,主要操作步骤如下图:

①该同学所采用的萃取剂可能是______________(填序号)。
A 酒精 B 苯 C 四氯化碳 D 汽油
②甲、乙、丙3步实验操作中,不正确的是_______________(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂:A 饱和食盐水 B NaOH溶液
请在以上实际中选择填空(填“A”或“B”):
①X溶液应选用________________。
②尾气处理过程中,多余的氯气可用________________吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯巴比妥是镇静、安眠类药物,其合成路线如下:
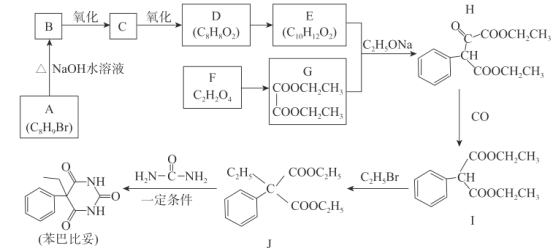
请回答下列问题:
(1)G的化学名称为_________,C的分子式为__________。
(2)F+X→G+ H2O,X的结构简式为____________。
(3)H中含有的官能团名称为__________,I→J的反应类型为______________。
(4)同时满足下列条件的E的同分异构体共有______种。
①含有苯环且苯环上有两个取代基
②能发生水解反应且能发生银镜反应
(5)化合物J→苯巴比妥的化学方程式为________________________________。
(6)以1,3-丁二烯、乙醇和尿素(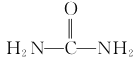 )为原料合成
)为原料合成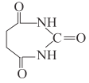 所需无机试剂任选,请写出流程:_____________________________
所需无机试剂任选,请写出流程:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
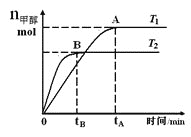
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
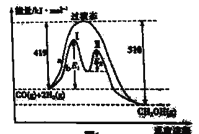
A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_______(填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=_____kPa/min;该温度下反应的平衡常数Kp=______。(分压=总压×物质的量分数)。
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____ K(L); 压强:p(M)__2p(L)。(填“>”“<”或“=”)

(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯(![]() )。电解时,阴极的电极反应式是_________。
)。电解时,阴极的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A.向 CH2BrCOOH中加入足量的氢氧化钠溶液并加热:![]()
B.用氢氧化钠溶液除去铝片表面的氧化膜:Al3++4OH-→AlO2-+2H2O
C.次氯酸钠溶液中通入少量的CO2气体:ClO-+CO2+H2O→HClO+HCO3-
D.等体积、等浓度的Ca(HCO)2溶液和NaOH溶液混合:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com