
【题目】甲醇是一种重要的工业原料,利用甲醇可以制氢气.
Ⅰ.甲醇与水蒸气反应可以直接制得氢气.
已知CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H>0,一定条件下,向体积为2L的恒容器密闭容器中充入1.2molCH3OH(g)和2.8molH2O(g),实验测得,反应共吸收的能量和甲醇的体积分数随时间变化的曲线图象如图1.
CO2(g)+3H2(g)△H>0,一定条件下,向体积为2L的恒容器密闭容器中充入1.2molCH3OH(g)和2.8molH2O(g),实验测得,反应共吸收的能量和甲醇的体积分数随时间变化的曲线图象如图1.
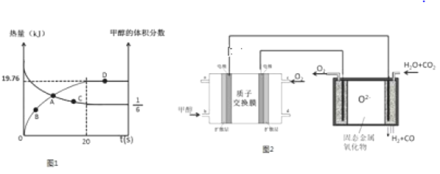
(1)从反应开始至平衡,H2的平均反应速率为___________.
(2)该条件下,CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的△H=__________,该反应的平衡常数为__________.
CO2(g)+3H2(g)的△H=__________,该反应的平衡常数为__________.
(3)在D点时,将容器的体积压缩为原来的一半,同时再充入7.2mol的H2O(g),CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)平衡_________________移动(填“往左”、“往右”或“不”).
CO2(g)+3H2(g)平衡_________________移动(填“往左”、“往右”或“不”).
Ⅱ.将甲醇燃料电池高温电解等物质的量的H2O﹣CO2混合气体可以间接制备H2.其基本原理如图2所示.
(4)甲醇燃料电池以酸性溶液为电解质,写出电池负极的电极反应式_________.
(5)电解池中发生的总反应方程式为_________________.
(6)当质子交换膜中通过的H+数目为4.816×1023时,理论上电解池中产生的H2为_______________L(标准状况).
【答案】0.03mol/(L·s) +49.4kJ/mol 0.09(mol/L)2 不 CH3OH+H2O﹣6e﹣=CO2+6H+ H2O+CO2![]() H2+CO+O2 4.48
H2+CO+O2 4.48
【解析】
(1)通过三段式求取浓度变化,再根据![]() 计算;
计算;
(2)参加反应的n(CH3OH)=0.2mol/L×2L=0.4mol,有0.4mol甲醇反应吸收19.76kJ热量,据此计算1mol甲醇反应吸收的热量;化学平衡常数![]() ;
;
(3))根据浓度商与化学平衡常数相对大小确定反应方向,如果浓度商等于平衡常数,则平衡不移动;
(4)甲醇燃料酸性电池中,负极上甲醇失电子发生氧化反应;
(5)电解池中,反应物是水和二氧化碳,生成物是氢气、CO和氧气;
(6)串联电路中转移电子相等,根据转移电子相等计算生成氢气体积.
反应前c(CH3OH)=1.2mol/2L=0.6mol/L、c(H2O)=2.8mol/L=1.4mol/L,设参加反应的c(CH3OH)为xmol/L,列三段式:
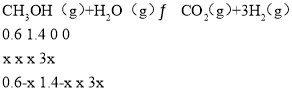
根据图知,反应后甲醇的体积分数占1/6,相同条件下体积之比等于其物质的量之比,所以甲醇的物质的量分数=![]() ,x=0.2则生成c(H2)=3x=3×0.2mol/L=0.6mol/L,故v(H2)=0.6mol/20s=0.03mol/(L·s);
,x=0.2则生成c(H2)=3x=3×0.2mol/L=0.6mol/L,故v(H2)=0.6mol/20s=0.03mol/(L·s);
(2)参加反应的n(CH3OH)=0.2mol/L×2L=0.4mol,有0.4mol甲醇反应吸收19.76kJ热量,据此计算1mol甲醇反应吸收的热量=19.76kJ/0.4mol=+49.4kJ/mol;化学平衡常数![]() =0.09(mol/L)2;故答案为:+49.4kJ/mol;0.09(mol/L)2;
=0.09(mol/L)2;故答案为:+49.4kJ/mol;0.09(mol/L)2;
(3)再充入7.2mol水蒸气,c(H2O)=7.2mol/1L==7.2mol/L,缩小容器体积时,c(CH3OH)=0.8mol/L、c(H2O)=9.6mol/L、c(CO2)=0.4mol/L、c(H2)=1.2mol/L,浓度商=![]() ,其浓度商等于化学平衡常数,所以平衡不移动,故答案为:不;
,其浓度商等于化学平衡常数,所以平衡不移动,故答案为:不;
(4)甲醇燃料酸性电池中,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH+H2O-6e-=CO2+6H+,故答案为:CH3OH+H2O-6e-=CO2+6H+;
(5)电解池中,反应物是水和二氧化碳,生成物是氢气、CO和氧气,故答案为:![]() ;
;
(6)串联电路中转移电子相等,正极反应式为O2+4e-+4H+=2H2O,通过离子交换膜的氢离子是4,当质子交换膜中通过的H+数目为4.816×1023时,即通过的氢离子物质的量=0.8mol,转移0.8mol电子得到0.8mol电子,根据转移电子相等得生成氢气体积=(0.8mol/4)×1×22.4L/mol=4.48L,故答案为:4.48。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:aA(g)+ bB(g)![]() cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
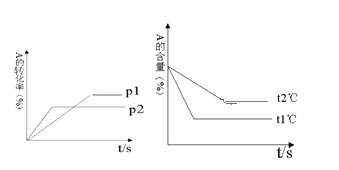
(1)压强p1 _________p2(填“>”或“<”);
(2)a +b__________c +d(填“>”或“<”);
(3)温度t1℃_________t2℃(填“>”或“<”);
(4)正反应为_________反应。(填吸热或放热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5mol/L、MgCO3的饱和溶液中c(Mg2+)为2.6×10-3mol/L.若在5mL浓度均为0.01mol/L的CaCl2和MgCl2溶液中,逐滴加入5mL 0.012mol/LNa2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A. 25℃时,Ksp(CaCO3)=2.8×10-9
B. 加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C. 滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO3-)>c(OH-)
D. 滤液M中: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是![]()
![]()
石油![]() 分馏产品
分馏产品![]() 乙烯
乙烯![]() .
.
A. 石油主要是由烃组成的混合物
B. ![]() 主要发生物理变化
主要发生物理变化
C. ![]() 包括裂化、裂解等过程
包括裂化、裂解等过程
D. ![]() 是加成反应,产物名称是二溴乙烷
是加成反应,产物名称是二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化。下列说法不正确的是( )

A.将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同
B.α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个
C.若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3
D.δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 加热氯化铁溶液颜色变深
C. 铁在潮湿的环境中生锈 D. 浓硫化钠溶液有臭味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述错误的是
A.分子中N—Cl键键长与CCl4分子中C—Cl键键长不相等
B.NCl3分子是极性分子
C.NBr3比NCl3易挥发
D.在氨水中,大部分NH3与H2O以氢键(用“![]() ”表示)结合形成NH3H2O分子,则NH3H2O的结构式为
”表示)结合形成NH3H2O分子,则NH3H2O的结构式为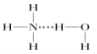
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com