
【题目】常温下将NaOH溶液添加到某二元弱酸H2A溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )

A.Ka2(H2A)的数量级为10-5B.NaHA溶液中c(H+)>c(OH-)
C.曲线M表示pH与![]() 的变化关系D.当混合溶液呈中性时:c (Na+) > c (HA-) > c (A2-)> c (OH-)=c (H+)
的变化关系D.当混合溶液呈中性时:c (Na+) > c (HA-) > c (A2-)> c (OH-)=c (H+)
【答案】B
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2A)>Ka2(H2A),酸性条件下,则pH相同时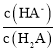 >
>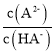 ,由图象可知N为
,由图象可知N为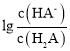 的变化曲线,M为
的变化曲线,M为 。
。
A.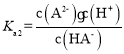 ,当
,当 =0时,
=0时,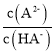 =1,此时pH≈5.4,则Ka2(H2A)≈10-5.4,可知Ka2(H2A)的数量级为10-6,故A错误;
=1,此时pH≈5.4,则Ka2(H2A)≈10-5.4,可知Ka2(H2A)的数量级为10-6,故A错误;
B.由图象可知, =0,即c(HA-)=c(A2-),此时pH≈5.4,可知HA-电离程度大于A2-水解程度,则NaHA溶液呈酸性,溶液中c(H+)>c(OH-),故B正确;
=0,即c(HA-)=c(A2-),此时pH≈5.4,可知HA-电离程度大于A2-水解程度,则NaHA溶液呈酸性,溶液中c(H+)>c(OH-),故B正确;
C.由以上分析可知曲线M表示pH与 的变化关系,故C错误;
的变化关系,故C错误;
D.由图象可知当pH=7时, >0,则c(A2-)>c(HA-),故D错误。
>0,则c(A2-)>c(HA-),故D错误。
故答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是

A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-===4OH-
D.U型管中溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是
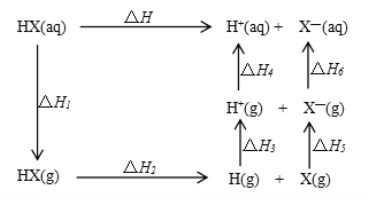
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.中和热的热化学方程式2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l);△H=-57.3 kJ/mol
B.氢气燃烧热的热化学方程式:H2(g)+![]() O2(g)=H2O(g);△H=-241.8 kJ/mol
O2(g)=H2O(g);△H=-241.8 kJ/mol
C.H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO4-+6H+=518O2↑+2Mn2++8H2O
D.向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ/mol
②C(s)+![]() O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol
③2C(s)+2O2(g)=2CO2(g) △H=-787 kJ/mol
回答下列问题:
(1)C(s)的标准燃烧热为______ 。
(2)写出CO燃烧的热化学方程式______。
(3)反应①经常用于实验室的中和热测定,测定装置如图1所示:

仪器A的名称是______,碎泡沫塑料的作用是______,用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得中和热的数值会______57.3 kJ/mol(填“大于”、“小于”或“等于”)。
(4)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点,图2为氢氧燃料电池的结构示意图,试回答下列问题:
①写出该氢氧燃料电池工作时负极的反应式 ______。
②用该电池电解饱和食盐水,当有1 molH2反应时,所产生的氯气用于制备漂白粉,可以制的漂白粉 ______克。
(5)钢铁生锈现象随处可见,钢铁的电化学腐蚀原理如图3所示:
①写出该电池反应的总反应方程式:______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图3虚线框内所示位置作出修改,并用箭头标出导线中电子流动的方向________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解化学方程式或水解离子方程式正确的是 ( )
A.NH4+ + H2O = NH3·H2O + H+B.CH3COO— + H2O![]() CH3COOH + OH—
CH3COOH + OH—
C.CH3COOH + NaOH![]() CH3COONa + H2OD.NaCl + H2O
CH3COONa + H2OD.NaCl + H2O![]() NaOH + HCl
NaOH + HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列问题:
CH4(g)+C3H6(g) ΔH2 回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物质,最稳定的是________________(填结构简式)。
②上述反应中,ΔH1=____________kJ·mol1。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。下列情况表明该反应达到平衡状态的是_________________(填代号)。
A.气体密度保持不变 B.![]() 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
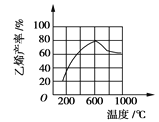
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,
随着温度升高,乙烯产率降低,可能的原因是____________(填代号)。
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为_____________;该反应的平衡常数K为____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e=6CO32-,负极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A. Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C. 2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃和某单烯烃的混合气体2.24 L(标准状况),使其完全燃烧,产生的气体完全通过浓硫酸,浓硫酸质量增加4.50 g,剩余气体通过碱石灰,碱石灰质量增加了7.70 g,另取该混合气体2.24 L(标准状况),通过足量溴水,溴水质量增加了1.40 g。该混合气体由哪两种烃组成( )
A.甲烷和丙烯B.甲烷和丁烯C.乙烷和乙烯D.乙烷和丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com