
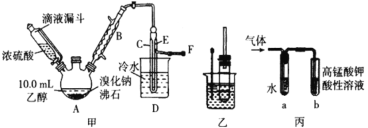
����Ŀ���������ƹ�����ñ��ʣ��������������ơ�ȡa g����������Ʒ��������ͼװ��ʵ�飬������Ʒ����(��������)��
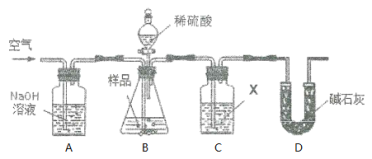
(1)��Cƿ�Լ�X��ѡ���ϣ���ͬѧ��Ϊʹ��������Ba(OH)2��Һ��������Ca(OH)2��Һ�����ʣ�������______________________��
(2)ʵ������������£���X���ü�ͬѧ�������
������A��B��ͨһ��ʱ��������ٽ���C��D��
�ڼ�ϡ���ᷴӦ��
�۷�Ӧ������ͨ�����㹻ʱ�䡣�ò�����Ŀ����________________��
�ܽ�C�����ʹ��ˡ�ϴ�ӡ�������أ���b g���塣�Դ˼��㣬����������Ʒ����Ϊ_____________��
(3)��ͬѧָ������������ʵ����ƫ��ԭ����(�û�ѧ��Ӧ����ʽ��ʾ)_____���Ľ��Ĵ�ʩ��__________________��
(4)������ͬѧ����Ľ���������ͬѧ�����Ҳ����ͨ������Cװ��ǰ����������������������ͬѧָ����˲�����ʵ������ƫС��ԭ����_______________��
(5)��ͬѧ��Ϊ���Գ���ǰ��������������ɳ���Dװ�ã���������3���������
�ٽ�Cƿ�Լ�X��Ϊ______________��
����Dװ�ú���Խ�________(��ѡ����)��
a. װ����ˮ�Ȼ��Ƶĸ���� b. װ�м�ʯ�ҵĸ����
c. װ��Ũ�����ϴ��ƿ d. װ������������Һ��ϴ��ƿ
������C֮ǰ(��C)��װ����ͨһ��ʱ�����壬�ٽ���D��֮���װ�á�
���𰸡�BaSO3��ѧʽ����CaSO3�����ʵ�������£�����ʱ�ģ�ϵͳ��������С��������Ca(OH)2�ܽ��С��������Һ��ˮ�϶࣬��ʹCaSO3�ܽ�������������������Ӱ�졣�� ��B�е�SO2ȫ������C�У�ʹ�䱻��ȫ���� ![]() 2BaSO3+O2=2BaSO4 ��������ͨ�����ȵ�ͭ������ͨ��A�����߸�ͨN2��H2��(��ʱ�Ͳ���װ��A��) ͨ�����������߲���ˮ������ʹ�������С Ũ���� bc
2BaSO3+O2=2BaSO4 ��������ͨ�����ȵ�ͭ������ͨ��A�����߸�ͨN2��H2��(��ʱ�Ͳ���װ��A��) ͨ�����������߲���ˮ������ʹ�������С Ũ���� bc
��������
��װ��B��ϡ��������Ʒ��Na2SO3��Ӧ����Na2SO4��SO2��H2O��SO2��C��Ba(OH)2�Լ����ղ���BaSO3���������ݲ�������������������Ʒ��Na2SO3�������������ɵ�Na2SO3�Ĵ��ȣ�װ��D�м�ʯ������CO2�����Է�ֹ������CO2��SO2�ⶨ��Ӱ�죻Ϊ�˷�ֹװ���п�����Ӱ�켰SO2������װ���в�����ȫ��Ba(OH)2�Լ����գ�Ҫ����A��Bװ����ͨ��һ��ʱ�䣬Ȼ��������B��C֮����ܣ���Ӧ��ȫ����ͨ�����һ��ʱ��Ŀ������ݴ˷������
(1)��Cƿ�Լ�X��ѡ���ϣ���ͬѧ��Ϊʹ��������Ba(OH)2��Һ��������Ca(OH)2��Һ�����ʣ�ԭ����BaSO3��ѧʽ����CaSO3�����ʵ�������£�����ʱ��������С��(����Ca(OH)2�ܽ��С��������Һ��ˮ�϶࣬��ʹCaSO3�ܽ�������������������Ӱ�졣)
(2)�۷�Ӧ������ͨ�����㹻ʱ�䡣�ò�����Ŀ���ǽ�B�е�SO2ȫ������C�У�ʹ�䱻��ȫ���գ���Сʵ����
�ܽ�C�����ʹ��ˡ�ϴ�ӡ�������أ���b g���塣n(BaSO3)=![]() mol����Na2SO3������Ϊm(Na2SO3)=nM=
mol����Na2SO3������Ϊm(Na2SO3)=nM=![]() mol��126 g/mol=
mol��126 g/mol=![]() g����������������Ʒ����Ϊ
g����������������Ʒ����Ϊ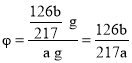 ��
��
(3)��ͬѧָ������������ʵ����ƫ��ԭ����ͨ������ų�װ���е�SO2����ʱ�������е�O2��BaSO3��������BaSO4����Ӧ����ʽΪ��2BaSO3+O2=2BaSO4���Ľ��Ĵ�ʩ�ǽ�������ͨ�����ȵ�ͭ������ȥ�����е�O2����ͨ��A�����߸�ΪͨN2��H2��(��ʱ�Ͳ���װ��A��)��
(4)������ͬѧ����Ľ���������ͬѧ�����Ҳ����ͨ������Cװ��ǰ����������������������ͬѧָ����˲�����ʵ������ƫС��ԭ����ͨ�����������߲���ˮ������ʹ�������С��
(5)��ͬѧ��Ϊ���Գ���ǰ��������������ɳ���Dװ�ã���������3���������
��Cƿ�Լ�X��ΪŨ����������ˮ�֣���װ��D���շ�Ӧ������SO2���壬Ϊ��ֹ������H2O��SO2���յ�Ӱ�죬��Dװ�ú���Խ�װ�м�ʯ�ҵĸ���ܻ�װ��Ũ�����ϴ��ƿ���ʺ���ѡ����bc��


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ȼ�ǵ�����ȵ����⡣�о�������������Ҫ���塣�ش��������⣺
��1��2NO(g)+O2(g)![]() 2NO2(g)�ķ�Ӧ���̷�������
2NO2(g)�ķ�Ӧ���̷�������
��2NO(g)![]() N2O2(g) �� ��H1<0
N2O2(g) �� ��H1<0
��N2O2(g)+O2(g)![]() 2NO2(g) �� ��H2<0
2NO2(g) �� ��H2<0
��Ӧ2NO(g)��O2(g)![]() 2NO2(g)��H=__(�ú�H1��H2��ʽ�ӱ�ʾ)����Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1__E2(����>������<������=��)��
2NO2(g)��H=__(�ú�H1��H2��ʽ�ӱ�ʾ)����Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1__E2(����>������<������=��)��
��2����ҵ�ϳ�����CH4������CO2����CO��H2������H2��CO�ϳɼ״������ں����ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ1.0mol��L-1��CH4��CO2����һ�������½�������Ӧ��CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��
2CO(g)+2H2(g)�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��
�ٸ÷�Ӧ����H___(����<����=������>��)0��
��ѹǿp1��p2��p3��p4�ɴ�С�Ĺ�ϵΪ___���жϵ�������______��ѹǿΪp4ʱ����b�㣺v(��)___(����<����=������>��)v(��)��
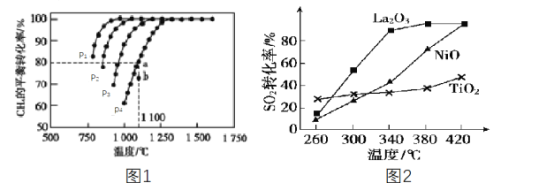
�۶������෴Ӧ����ij���(B)��ƽ��ѹǿp(B)�������ʵ���Ũ��c(B)Ҳ�ɱ�ʾƽ�ⳣ��(����Kp)����p4=0.36MPa����a���ƽ�ⳣ��Kp=___(����3λ��Ч���֣���ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
��3��ȼú��������Ļ��շ�ӦΪ2CO(g)��SO2(g)=2CO2(g)��S(l)��������������ͬ��������ͬʱ����Ļ��շ�Ӧ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼ2��ʾ��260��ʱ��____ (����La2O3��NiO������TiO2��)�Ĵ�Ч����ߡ�La2O3��NiO������������ʹSO2��ת���ʴﵽ�ܸߣ������Ǽ۸����أ�ѡ��La2O3����Ҫ�ŵ���__��
��4����С����Na2SO3��Һ�������SO2�õ�NaHSO3��Һ��Ȼ�������Һ�Ƶ������ᡣԭ����ͼ3��д����ʼ���ʱ�����ĵ缫��Ӧʽ__��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����ʵ�������Ҵ���Ũ������廯�ƺ�ˮ��Ϸ�Ӧ���Ʊ������飬��̽������������ʡ��й����ݼ��±���
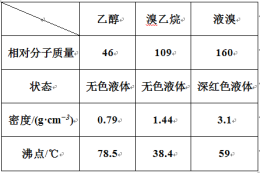
I. ��������Ʊ�
��Ӧԭ�����£�ʵ��װ������ͼ������װ�á��г�װ�þ�ʡ�ԣ���
H2SO4+NaBr ![]() NaHSO4+HBr�� CH3CH2OH+HBr
NaHSO4+HBr�� CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
��1�� ͼ����A ����������_____��ͼ��B �����ܵ�����Ϊ_____��
��2�� ��ͼ����A �����¶ȹ���Ũ�����Ũ�ȹ�����ʹ C ���ռ����Ĵֲ�Ʒ�ʳ�ɫ��ԭ����A �з����˸���Ӧ������_____��F ���ӵ���ͨ��ϡNaOH ��Һ�У���Ŀ����Ҫ������_____��β����ֹ��Ⱦ����
II. ���������ʵ�̽��
����ͼʵ��װ����֤����������ʣ�
��3�� �������Թ��ڼ��� 10mL6mol��L ��1NaOH ��Һ�� 2mL �����飬�����ã�Һ��ֲ㣬ˮԡ���ȡ��ù����еĻ�ѧ����ʽΪ_______��
��4�� ���������Թ���� NaOH ��Һ����NaOH �Ҵ���Һ��Ϊ֤������Ϊ��ϩ�������ɵ�����ͨ����ͼ��װ�á�a �Թ��е�ˮ��������_______������ a �Թܣ������ɵ�����ֱ��ͨ�� b �Թ��У��� b�е��Լ�����Ϊ _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y�Ƕ�����Ԫ�أ����ǿ���ɻ�����XY��������˵����ȷ����
A.XY����һ�������Ӿ���
B.��Y��ԭ������Ϊm��X��ԭ������һ����m![]() 6
6
C.X��Y��������ͬһ���ڣ�Ҳ�ɾ���������ͬ����
D.X��Yһ��������ͬһ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҵʼ�� 18 ����ĩ�������������ٶ��ꡣ�ڴ��ҵʷ�ϣ�����ʱ������ά���й��˺�°�ȶ�������ͻ���Ĺ��ס��ݴ��������С�⡣
��1����ͼ��1861������ά�������Ƽ������ת����ϵͼ������I~IV�����ĸ���Ҫ��ѧ��Ӧ��a~i������H2O���ⲻͬ�����ʡ�������������ģ�������˵����ȷ���ǣ� ��
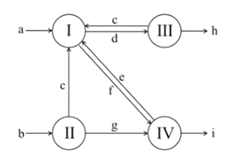
A.ˮ��Һ�ʼ��Ե�����ֻ��e��g��h
B.ˮ��Һ�����Ե�����ֻ��c��f��i
C.ÿ����1mol a��ͬʱ����0.5mol b
D.ÿ����1mol h��ͬʱ����0.5mol i
��2����ĸҺ��������NaHCO3�к���NH4Cl����ϴ�Ӻ��ٽ������ա���ʡ��ϴ�Ӳ����������ն����ô����Ӱ��������ȷ���ǣ� ��
A.������Ӱ��B.NH4Cl���ʺ�������
C.NaCl���ʺ�������D.NaOH���ʺ�������
��3������ר�Һ�°�����"�����Ƽ"����ƽ��˴��ҵ�ķ�չ��������Ҫ�����ǣ� ��
A.�ҵ�������Ч�Ĵ���B.�������������
C.����˴����Ʒ�Ĵ���D.������Na+��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25��ʱ0.1molL-1�İ�ˮ����ش��������⣺
��1����ˮ�ʼ��Ե�ԭ��Ϊ�������ӷ���ʽ��ʾ��___��
��2������ˮ�м���ϡ���ᣬʹ��ǡ���кͣ�д����Ӧ�����ӷ���ʽ___����������Һ��pH=5������Һ��ˮ���������������Ũ��Ϊ___��
��3������ˮ�м�����������粒��壬��ʱ��Һ��![]() __������������������С����������������
__����������������������������������
��4������ˮ�м���ϡ��������Һ��pH=7����ʱc��NH4+��=amolL-1����c��SO42-��=__��
��5������ˮ�м���pH=1�����ᣬ�Ұ�ˮ������������Ϊ1��1����������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳����___��
��6����������ͨ��0.1mol/L���Ȼ�����Һ�������ͣ����������������백ˮ��������ɫ�������õ���ƽ�����ԭ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��ŵ������ѧ�������Լ��������˹�����ŵ��ɷ����˶���˹̹������͢��ķ�ͼ�Ұ�ã��Ա������Ƕ�����ӵ���з��Ĺ��ס�Ŀǰ�ȫ������ӵ����LiFePO4��أ��ṹ��ͼ��ʾ������м��Ǿۺ���ĸ�Ĥ��ֻ����Li+ͨ����
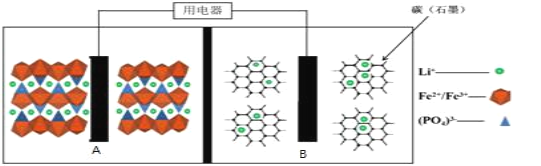
ԭ�����£�(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC��
LiFePO4+nC��
����˵������ȷ���ǣ� ��
A.�ŵ�ʱ��B�缫����������Ӧ
B.�ŵ�ʱ������ת��1mol���ӣ�B�缫����������7xg
C.���ʱ��A���缫��Ӧʽ��xLiFePO4-xe-=xFePO4+xLi+
D.���ʱ��Li+��A�缫����B�缫���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼ�����ӽṹ��˵���д������( )
A.������������ṹB.����ƽ�������νṹ
C.���е�C��H������ȫ��ͬD.���е���ԭ�Ӷ���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ��õĻ�ԭ����ijУ������ѧС��̽�����ᱻ�������������⡣
ʵ��� | �Լ� | ��Ϻ� ��ҺpH | ���� (1 h����Һ) | ||
�Թ� | �ι� | ||||
| a | 4mL0.01molL-1KMnO4��Һ������ŨH2SO4 | 2 mL0.3molL-1 H2C2O4��Һ | 2 | ��Ϊ��ɫ |
b | 4mL0.01molL-1KMnO4��Һ������ŨNaOH | 7 | �����Ա仯 | ||
c | 4mL0.01molL-1K2Cr2O7��Һ������ŨH2SO4 | 2 | �����Ա仯 | ||
d | 4mL0.01molL-1K2Cr2O7��Һ������ŨNaOH | 7 | �����Ա仯 | ||
(1)H2C2O4�Ƕ�Ԫ���ᣬд��H2C2O4����ˮ�ĵ��뷽��ʽ��___________��
(2)ʵ����Թ�a��KMnO4���ձ���ԭΪMn2+���÷�Ӧ�����ӷ���ʽΪ__________��
(3)�����ͳ����������ϣ�ʵ����Թ�c��H2C2O4��K2Cr2O7��Һ��Ӧ������ʱ�������ɣ�������MnO2�ɴٽ�H2C2O4��K2Cr2O7�ķ�Ӧ�����ݴ����ϣ����������������ʵ��֤ʵ����һ�㡣
ʵ��� | ʵ��� | ʵ��� | |
ʵ�� ���� |
|
|
|
ʵ�� ���� | 6min�������ȫ�ܽ⣬��Һ��ɫ��dz���¶Ȳ��� | 6min�����δ�ܽ⣬��Һ��ɫ�����Ա仯 | 6min�����δ�ܽ⣬��Һ��ɫ�����Ա仯 |
ʵ�����Ŀ���ǣ�_______________��
(4)�����ȶ�ʵ��II��������̽����������Һ��Cr2O72-Ũ�ȱ仯��ͼ��

�갺Ͳ̲���Ϊ�˱仯��ͨ����������ʵ�ֵġ�
����i��MnO2��H2C2O4��Ӧ������Mn2+��
����ii��___________��
�ٲ������ϣ���Һ��Mn2+�ܱ�PbO2����ΪMnO4-����Թ���i���ɲ������·���֤ʵ����0.0001mol MnO2���뵽6mL______�У�������ȫ�ܽ⣻����ȡ��������Һ���������PbO2���壬��ַ�Ӧ���ã��۲쵽________________��
�ڲ����������ʵ�鷽��֤ʵ�˹���ii���������ǵ�ʵ�鷽�����£���2mL��0.3mol/LH2C2O4��Һ��4mL0.01mol/LK2Cr2O7��Һ��ϣ�����pH=2������0.0001molMnSO4���壬6���Ӻ�����Ϊ��______________
(5)�ۺ�����ʵ���֪�����ᷢ��������Ӧ��������____________�йء�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com