
【题目】现有25℃时0.1molL-1的氨水,请回答以下问题:
(1)氨水呈碱性的原因为(用离子方程式表示)___。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式___;若所得溶液的pH=5,则溶液中水所电离出的氢离子浓度为___。
(3)若向氨水中加入少量硫酸铵固体,此时溶液中![]() __(填“增大”、“减小”或“不变”)。
__(填“增大”、“减小”或“不变”)。
(4)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amolL-1,则c(SO42-)=__。
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___。
(6)二氧化硫通入0.1mol/L的氯化钡溶液中至饱和,无现象,若继续加入氨水,产生白色沉淀,用电离平衡解释原因___。
【答案】NH3·H2O![]() NH4++OH- NH3H2O+H+=NH4++H2O c(H+)=1×10-9molL-1 减小
NH4++OH- NH3H2O+H+=NH4++H2O c(H+)=1×10-9molL-1 减小 ![]() molL-1 c(NH4+)>c(SO42-)>c(H+)>c(OH-) 因为二氧化硫和水反应生成的是亚硫酸,而亚硫酸属于弱酸,不能制取氯化氢这样的强酸,所以不能生成沉淀,而氨水是可以吸收二氧化硫生成亚硫酸根,亚硫酸根会与钡离子生成亚硫酸钡沉淀
molL-1 c(NH4+)>c(SO42-)>c(H+)>c(OH-) 因为二氧化硫和水反应生成的是亚硫酸,而亚硫酸属于弱酸,不能制取氯化氢这样的强酸,所以不能生成沉淀,而氨水是可以吸收二氧化硫生成亚硫酸根,亚硫酸根会与钡离子生成亚硫酸钡沉淀
【解析】
(1)氨水中的一水合氨能够部分电离,使溶液显碱性;
(2)若向氨水中加入稀盐酸,使其恰好中和,反应生成(NH4)2SO4和水;pH=5,c(H+)=1×10-5molL-1,根据离子积常数计算c(OH-),水所电离出的c(H+)等于水所电离出的c(OH-),据此分析解答;
(3)向氨水中加入少量硫酸铵固体,铵根离子浓度增大,结合氨水的电离平衡分析判断;
(4)根据电荷守恒计算硫酸根离子浓度;
(5)pH=1的硫酸溶液,c( H +)=0.1molL-1,氢离子浓度与氨水浓度相等,恰好反应生成铵根离子,溶液中的溶质是硫酸铵,结合铵根离子水解分析解答;
(6)二氧化硫与水反应生成亚硫酸,亚硫酸与氯化钡不反应,再加入氨水,氨水与亚硫酸反应生成亚硫酸盐,据此分析解答。
(1)氨水中的一水合氨能够部分电离,使溶液显碱性,NH3·H2O![]() NH4++OH-,故答案为:NH3·H2O
NH4++OH-,故答案为:NH3·H2O![]() NH4++OH-;
NH4++OH-;
(2)若向氨水中加入稀盐酸,使其恰好中和,反应生成(NH4)2SO4和水,反应的离子方程式为NH3H2O+H+=NH4++H2O,pH=5,c(H+)=1×10-5molL-1,根据离子积常数,c(OH-)=![]() =1×10-9molL-1,则水所电离出的c(H+)等于水所电离出的c(OH-),因此水所电离出的c(H+)=1×10-9molL-1,故答案为:NH3H2O+H+=NH4++H2O;1×10-9molL-1;
=1×10-9molL-1,则水所电离出的c(H+)等于水所电离出的c(OH-),因此水所电离出的c(H+)=1×10-9molL-1,故答案为:NH3H2O+H+=NH4++H2O;1×10-9molL-1;
(3)由于(NH4)2SO4=2NH4++SO42-,向氨水中加入少量硫酸铵固体,溶液中NH4+浓度增大,抑制氨水的电离,导致溶液中氢氧根离子浓度减小,一水合氨分子浓度增大,所以此时溶液中![]() 减小,故答案为:减小;
减小,故答案为:减小;
(4)pH=7,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42- )+c(OH-),所以c(SO42- )=0.5c(NH4+)=0.5a molL-1,故答案为:0.5a molL-1;
(5)pH=1的硫酸溶液,c( H +)=0.1molL-1,氢离子浓度与氨水浓度相等,体积相同,所以恰好反应生成盐,如果NH4+不水解,c( NH4+)∶c(SO42-)=2∶1,但水解是较弱的,所以c(NH4+)>c(SO42- );溶液呈酸性,所以c(H+)>c(OH-),故溶液中离子浓度大小顺序是c(NH4+)>c(SO42- )>c(H+)>c(OH-),故答案为:c(NH4+)>c(SO42- )>c(H+)>c(OH-)。
(6)二氧化硫通入0.1mol/L的氯化钡溶液中至饱和,二氧化硫与水反应生成亚硫酸,亚硫酸与氯化钡不反应,因此无明显现象,若继续加入氨水,氨水与亚硫酸反应生成亚硫酸盐,再与钡离子反应生成亚硫酸钡沉淀,因此产生白色沉淀,故答案为:因为二氧化硫和水反应生成的是亚硫酸,而亚硫酸属于弱酸,不能制取氯化氢这样的强酸,所以不能生成沉淀,而氨水是可以吸收二氧化硫生成亚硫酸根,亚硫酸根会与钡离子生成亚硫酸钡沉淀。


科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,如:①硫酸亚铁片用于治疗贫血(下图是其说明书),②复方氢氧化铝用于治疗胃酸过多,③明矾用作净水剂,等等。

阅读上方“硫酸亚铁片”的标签说明,回答:
(1) “鉴别”中,“加稀盐酸1滴”的作用是_____________________________________;不是加稀硫酸的原因是_______________________________________。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝作为_________中和过多胃酸;氢氧化铝也能跟烧碱溶液反应,反应的离子方程式为_________________________。
(3)明矾能净水是因为①Al3+能水解,②水解产物氢氧化铝具有____________能力。设计一个简单实验验证明矾溶于水发生了水解__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9.2g金属钠投入足量重水(D2O)中,则产生的气体中含有( )
A.0.2 mol中子B.0.2 mol质子C.0.4 mol电子D.0.4 mol分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL2 mol/L的氯化铁溶液中,充分反应后,其结果是
A.铁有剩余
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物与还原产物的物质的量之比为2:5
D.溶液中的Fe2+和Fe3+的物质的量之比为6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠固体久置变质,部分生成硫酸钠。取a g亚硫酸钠样品,依照如图装置实验,分析样品纯度(质量分数)。
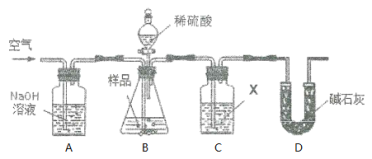
(1)在C瓶试剂X的选择上,甲同学认为使用足量的Ba(OH)2溶液比足量的Ca(OH)2溶液更合适,理由是______________________。
(2)实验操作步骤如下:(X采用甲同学意见)。
①先在A、B中通一段时间空气,再接上C、D;
②加稀硫酸反应;
③反应结束,通空气足够时间。该操作的目的是________________;
④将C中物质过滤、洗涤、干燥、称重,得b g固体。以此计算,亚硫酸钠样品纯度为_____________。
(3)乙同学指出,上述操作实验结果偏大,原因是(用化学反应方程式表示)_____;改进的措施是__________________。
(4)依据乙同学意见改进方案后,乙同学又提出也可以通过称量C装置前后的质量差来分析结果。丙同学指出如此操作,实验结果将偏小,原因是_______________。
(5)丙同学认为若以称重前后差量来分析,可称量D装置,并从以下3方面调整:
①将C瓶试剂X换为______________。
②在D装置后可以接________(填选项编号)。
a. 装有无水氯化钙的干燥管 b. 装有碱石灰的干燥管
c. 装有浓硫酸的洗气瓶 d. 装有氢氧化钠溶液的洗气瓶
③先在C之前(含C)的装置中通一段时间气体,再接上D及之后的装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。乙醚浸取法的主要工艺如图所示:
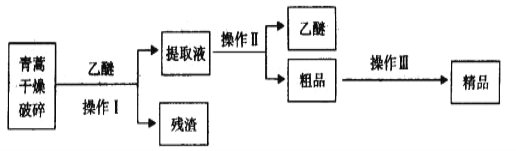
已知:青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。乙醚沸点为35℃。下列叙述错误的是( )
A.对青蒿干燥破碎后,加入乙醚的目的是溶解青蒿素
B.操作Ⅰ需要的玻璃仪器主要有烧杯、漏斗、玻璃棒
C.操作Ⅱ的名称是过滤
D.操作Ⅲ的主要过程可能是加95%的乙醇,浓缩、结晶、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是化工生产重要原料甲叉琥珀酸的合成路线:

已知:R-Br+NaCN→R-CN+NaBr,R-CN![]() R-COONa+NH3↑,R-CCl3
R-COONa+NH3↑,R-CCl3![]() R-COONa+NaCl。
R-COONa+NaCl。
(1)已知A核磁共振氢谱中有两组吸收峰,且A不存在顺反异构,则A的名称为____。
(2)E的官能团名称为_____,B→C的反应类型是_____。
(3)写出下列过程的化学反应方程式:E→F:_____。
(4)写出符合下列条件的甲叉琥珀酸的同分异构体M的结构简式___。
①M可以使酸性高锰酸钾褪色
②1molM和足量的NaHCO3溶液反应,最多放出2molCO2
③核磁共振氢谱中只有三组吸收峰
(5)应用已学知识,以![]() 为原料设计合成
为原料设计合成![]() 的路线图(无机试剂任选)。____
的路线图(无机试剂任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是

A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:W<Z<X<Y
C. Z的最高价氧化物的水化物可能为强碱
D. W的最高正化合价与负化合价的绝对值可能相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com