
����Ŀ������������ȡ�����صķ���֮һ������ȡԭ��Ϊ�����ġ����ѽ�ȡ������Ҫ������ͼ��ʾ��
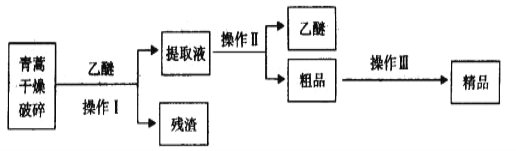
��֪�������������ĺ��������Ϊ��ɫ��״���壬�����ڱ�ͪ���ȷºͱ��У��ڼ״����Ҵ������ѡ�ʯ�����п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156-157�棬���ȶ��Բ�������Ǹ�Ч�Ŀ�űҩ�����ѷе�Ϊ35�档��������������ǣ� ��
A.�������������������ѵ�Ŀ�����ܽ�������
B.��������Ҫ�IJ���������Ҫ���ձ���©����������
C.������������ǹ���
D.���������Ҫ���̿����Ǽ�95%���Ҵ���Ũ�����ᾧ������
���𰸡�C
��������
��������ﵷ�飬�������ܽ������أ����˳�ȥ�����õ���ȡҺ������ȡҺ����õ������ش�Ʒ���ٽ���Ʒ��95%���Ҵ��ܽ⡢Ũ�����ᾧ�����˵õ���Ʒ��
A���������������������ѵ�Ŀ���ǽ������ش��������ܽ������A��ȷ��
B���������ǹ��˲�������Ҫ�IJ���������Ҫ���ձ���©������������B��ȷ��
C��������������C����
D�����������Ҫ�����Ǽ�95%���Ҵ��ܽ⣬Ũ�����ᾧ�����˵õ���Ʒ��D��ȷ��
��ѡC��


 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ����ͭ���壨CuSO4XH2O ����Xֵ��ʵ��������£�
![]()
��1��������ʵ�����õ��ļ����������������Ӧ������ȷ����___________��
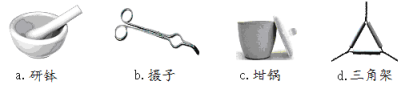
��2�������ա�ʱ��Դѡ�õ��Ǿƾ��ƶ����Ǿƾ���ƣ�������_____________________������ȴ������_______________��(����������)��
��3�� �����ء�������Ŀ����_________________________________________________��
�жϡ����ء���������_________________________________________________��
��4��������ijѧ��ʵ���һ�����ݣ�����ɼ���
�������� | �����뾧�������� | ���Ⱥ���������������� |
11.721g | 22.692g | 18.631g |
X=__________________��(��ȷ��0.01)��ʵ����������_________________��(����С�����һλ)
��5�����ʵ���в�������ԭ�������__________����ɵġ�
a������ͭ�����к��в��ӷ������ʡ��� b���ڼ��ȹ��̷����к�ɫ��������
c������ʱ�о���ɽ����������������� d������ʧˮ��¶���ڿ�������ȴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ�Ͻ��ѳ�Ϊ�ɻ����죮������������ҵ����Ҫ���ϡ��о���ѧϰС���ͬѧ��Ϊ�ⶨij��þ3%-5%��þ���Ͻ𣨲�������Ԫ�أ���þ�����������������������ʵ�鷽������̽������д���пհף�
������������þ�Ͻ�������NaOH��Һ��Ӧ���ⶨʣ�����������
��1��ʵ���з�����Ӧ�Ļ�ѧ����ʽ��___________________________________________��
��2����___________��ȡ5.400 g��þ�Ͻ��ĩ��Ʒ������V mL 2.0 mol/L NaOH��Һ�У�Ϊʹ�䷴Ӧ��ȫ����NaOH��Һ�����V��________mL��
��3��__________��ϴ�ӡ�__________���������塣�ò�������δϴ�ӹ��壬���þ������������__________������ƫ������ƫ����������Ӱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ�����ᷴӦ������ͭ��
(1)��������ᾧˮ�����ⶨʵ���У����ز�����ɵı���______________��
(2)������ͼװ�ü�����ˮ����ͭ��ĩֱ����ȫ�ֽ⣬A���Թ���ʣ���ɫ��ĩ���ô����ǵ�ľ�����뼯��ƿD������ľ���ܸ�ȼ����Ӧǰ���װ�õ�������ͼ�·��ı�����ʾ��

װ�� | A(�Թ�+��ĩ) | B | C |
��Ӧǰ | 50.0 g | 70.0 g | 540.0 g |
��Ӧ�� | 45.0 g | 74.5 g | 540.0 g |
��ͨ�����㣬�ƶϸ�ʵ������������ͭ�ֽ�Ļ�ѧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25��ʱ0.1molL-1�İ�ˮ����ش��������⣺
��1����ˮ�ʼ��Ե�ԭ��Ϊ�������ӷ���ʽ��ʾ��___��
��2������ˮ�м���ϡ���ᣬʹ��ǡ���кͣ�д����Ӧ�����ӷ���ʽ___����������Һ��pH=5������Һ��ˮ���������������Ũ��Ϊ___��
��3������ˮ�м�����������粒��壬��ʱ��Һ��![]() __������������������С����������������
__����������������������������������
��4������ˮ�м���ϡ��������Һ��pH=7����ʱc��NH4+��=amolL-1����c��SO42-��=__��
��5������ˮ�м���pH=1�����ᣬ�Ұ�ˮ������������Ϊ1��1����������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳����___��
��6����������ͨ��0.1mol/L���Ȼ�����Һ�������ͣ����������������백ˮ��������ɫ�������õ���ƽ�����ԭ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ�ﱴŵ����������ˮ����Ͷ�������������һ�������·�Ӧ�Ƶã�
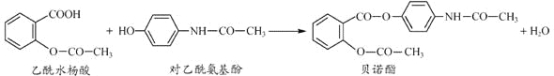
�����й�������ȷ���ǣ� ��
A. ��ŵ�������������ֺ���������
B. ����FeCl3��Һ��������ˮ����Ͷ�����������
C. ����ˮ����Ͷ����������Ӿ�����NaHCO3��Һ��Ӧ
D. ��ŵ��������NaOH ��Һ���ȣ�������������ˮ�����ƺͶ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�
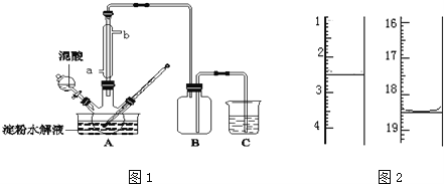
�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�ⷨ��ȡ Na2FeO4 ��װ��ͼ��ͼ��ʾ������˵����ȷ���ǣ����������¶ȱ� �ֲ��䣬��Һ����仯���Բ��ƣ�
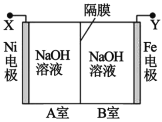
A.Y ����ӵ�Դ��������Fe �缫�Ϸ�����ԭ��Ӧ
B.Ni �缫�Ϸ����ĵ缫��ӦΪ��2H2O �� 4e��== O2����4H��
C.����ĤΪ�����ӽ���Ĥ����������� OH���� B �ҽ��� A ��
D.����ȥ��Ĥ����ֻ�ϣ����Һ�� pH ��ԭ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��O��Na��Cl��Fe��Cu��Ԫ�����ڱ�ǰ�������еij���Ԫ�ء�
(1)Fe��Ԫ�����ڱ��е�λ����_____��Cu��̬ԭ�Ӻ�������Ų�ʽΪ________��
(2)C��O����̬�⻯���У����ȶ�����________��д��ѧʽ����C�ĵ縺�Ա�Cl��________�����С������
(3)д��Na2O2��CO2��Ӧ�Ļ�ѧ����ʽ____________________________��
(4)̼�ж���ͬ�������壬����ʯīϩ����ʯ�ľ���ṹ��ͼ��ʾ��
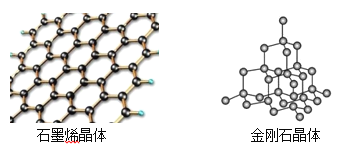
����ʯīϩ�����У�ÿ��Cԭ������___________����Ԫ����ÿ����Ԫ��ռ��___________��Cԭ�ӡ�
���ڽ��ʯ�����У�Cԭ�������ӵ���С��ҲΪ��Ԫ����ÿ��Cԭ������__________����Ԫ������Ԫ���������_________��Cԭ����ͬһƽ�档
(5)��ʴӡˢ��·�ķ�Һ�к��д�����CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ�Ϊ��ʹFeCl3ѭ�����úͻ���CuCl2�����չ������£�

���Լ�X�Ļ�ѧʽΪ______________��
����������1 L��Һ�к�CuCl2��FeCl2��FeCl3�����ʵ���Ũ�Ⱦ�Ϊ0.5 mol��L��1�������Cl2������X���ˡ�Ϊʹ��Һ��Ԫ����ȫת��ΪFe(OH)3����CuCl2 ��������������Ӧ����pH�ķ�Χ��____________________________������Һ������ֲ��䣩����֪��Ksp[Fe(OH)3]��1.0��10��38��Ksp[Cu(OH)2]��2.0��10��20��lg5��0.7��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com