
【题目】铝镁合金已成为飞机制造.化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的镁铝合金(不含其它元素)中镁的质量分数,设计下列如下实验方案进行探究。填写下列空白:
(方案)将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________________________。
(2)用___________称取5.400 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥________mL。
(3)__________、洗涤、__________、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”“偏低”或“无影响”)
【答案】![]() 电子天平 97 过滤 烘干 偏高
电子天平 97 过滤 烘干 偏高
【解析】
铝为两性金属,能与氢氧化钠反应,镁在碱性环境下不反应。通过计算产生气体的量计算铝的质量,实验过程中应以镁的最小质量分数估计氢氧化钠的用量。
(1)实验中发生反应的化学方程式是![]() ;
;
(2)数值为小数点后三位,托盘天平只能估读到小数点后二位,精确称量用电子天平称取铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,假设5.400g中含有镁3%,则铝的质量为5.238g,需要氢氧化钠0.194mol,体积为97ml,NaOH溶液的体积V≥97ml
(3)反应之后,经过过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,镁表面会附着少量的偏铝酸钠等物质,导致测得镁的质量分数将偏高。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】常温下,在HA和NaA的混合溶液中 c(HA)+c(A-)=0.1 mol·L-1,溶液中c(HA) 和c(A-)的大小随着pH变化的关系如图所示。下列有关叙述不正确的是
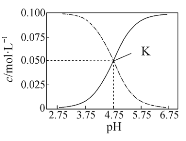
A.常温下,HA的电离平衡常数约为10-5
B.在pH=3.75溶液中:c(Na+)+c(H+)+c(HA) = c(OH-) +0.1 mol·L-1
C.在pH=5.75溶液中:c(OH-)<c(H+)<c(A-)<c(HA)
D.在K点的溶液中,HA的电离程度大于A-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-)=2:1,溶液中由水电离出的c(H+)=__。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2和H2充入一定体积的密闭容器中,反应过程和在两种温度下CH3OH的物质的量随时间的变化如图所示。
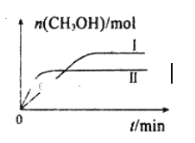
①已知图所示反应每消耗1molH2,热量变化是16.3kJ,则反应的热化学方程式为__。曲线I、Ⅱ对应的平衡常数大小关系为K1__K2(填“>”或“=”或“<”)。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是__。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H—H断裂
③一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
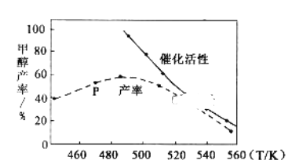
当温度为470K时,图中P点__(填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是__。
(3)用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,可能的机理如图所示。
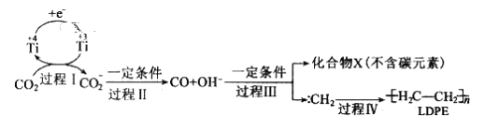
则过程I中阴极电极反应式__,工业上生产1.4×104g的LDPE,转移电子的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取相同质量的H2O和D2O分别与少量金属钾反应完全,若电子转移数目相同,则下列叙述中有关物理量不相等的是( )
A.反应消耗H2O和D2O的物质的量B.产生气体在相同条件下的体积
C.反应后所得溶液溶质的质量分数D.参加反应金属钾的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9.2g金属钠投入足量重水(D2O)中,则产生的气体中含有( )
A.0.2 mol中子B.0.2 mol质子C.0.4 mol电子D.0.4 mol分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,甲、乙两烧杯均盛有5mLpH=3的醋酸溶液,向乙烧杯加水稀释至溶液pH=4,关于两烧杯中所得溶液的描述正确的是( )
A.溶液体积:10V甲<V乙
B.水电离出的OH-浓度:10c(OH-)甲 < c(OH-)乙
C.若分别用等物质的量浓度的NaOH溶液完全中和,所得溶液的pH:甲<乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL2 mol/L的氯化铁溶液中,充分反应后,其结果是
A.铁有剩余
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物与还原产物的物质的量之比为2:5
D.溶液中的Fe2+和Fe3+的物质的量之比为6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。乙醚浸取法的主要工艺如图所示:
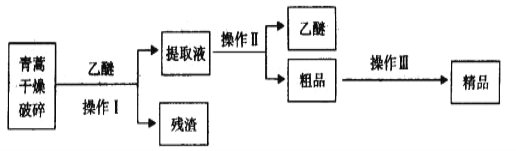
已知:青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。乙醚沸点为35℃。下列叙述错误的是( )
A.对青蒿干燥破碎后,加入乙醚的目的是溶解青蒿素
B.操作Ⅰ需要的玻璃仪器主要有烧杯、漏斗、玻璃棒
C.操作Ⅱ的名称是过滤
D.操作Ⅲ的主要过程可能是加95%的乙醇,浓缩、结晶、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,某金属有机多孔材料(MOFA)对CO2具有超高的吸附能力,并能催化CO2与环氧丙烷的反应,其工作原理如图所示。下列说法错误的是
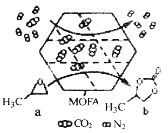
A.物质a分子中碳原子和氧原子均采取sp3杂化
B.b的一氯代物有3种
C.a生成b的反应类型为取代反应,并有极性共价键形成
D.该材料的吸附作用具有选择性,利用此法可减少CO2的排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com