
【题目】常温下,在HA和NaA的混合溶液中 c(HA)+c(A-)=0.1 mol·L-1,溶液中c(HA) 和c(A-)的大小随着pH变化的关系如图所示。下列有关叙述不正确的是
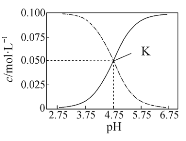
A.常温下,HA的电离平衡常数约为10-5
B.在pH=3.75溶液中:c(Na+)+c(H+)+c(HA) = c(OH-) +0.1 mol·L-1
C.在pH=5.75溶液中:c(OH-)<c(H+)<c(A-)<c(HA)
D.在K点的溶液中,HA的电离程度大于A-的水解程度
【答案】C
【解析】
由图像知实线为c(A-)浓度大小,虚线为c(HA)浓度大小,
A. 根据图像K点知,此时c(A-)=c(HA)=0.050mol/L,c(H+)=10-4.75mol/L,则常温下,HA的电离平衡常数![]() ,即数量级为
,即数量级为![]() ,故A正确;
,故A正确;
B. 根据电荷守恒得:c(Na+)+c(H+) = c(OH-) +c(A-),已知c(HA)+c(A-)=0.1 mol·L-1,两式相加得c(Na+)+c(H+)+c(HA) = c(OH-) +0.1 mol·L-1,故B正确;
C. 在pH=5.75溶液时,溶液呈酸性,c(OH-)<c(H+);由图像知,c(HA)<c(A-)中,故C错误;
D. 由选项A知HA的电离平衡常数Ka=c(H+)=10-4.75,则A-的水解平衡常数Kh=![]() <10-4.75,Kh<Ka,说明HA的电离程度大于A-的水解程度,故D正确;
<10-4.75,Kh<Ka,说明HA的电离程度大于A-的水解程度,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A.干粉灭火器和泡沫灭火器的工作原理相同
B.实验室配制1.0 molL-1的NaOH溶液定容时俯视刻度线,配制溶液浓度偏低
C.国产大飞机C919发动机使用的氮化硅属于无机非金属材料
D.冰水混合物、四氧化三铁、纯净矿泉水都不是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
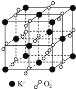
A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B. 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧与2价氧的数目比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(![]() )等化合物。
)等化合物。
(1)铝单质与同周期中非金属性最强的元素的气态氢化物的水溶液之间发生反应的离子方程式为:____________
(2)某元素与铝元素同周期且原子半径比镁原子半径大,写出该元素符号______,该元素的最高价氧化物的水化物与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:______________
(3)![]() 、MgO和
、MgO和![]() 都可以制耐火材料,其原因是______
都可以制耐火材料,其原因是______
a. ![]() 、MgO和
、MgO和![]() 都是白色固体
都是白色固体
b. ![]() 、MgO和
、MgO和![]() 都是氧化物
都是氧化物
c. ![]() 、MgO和
、MgO和![]() 都有很高的熔点
都有很高的熔点
(4)氢氧化铝在强酸溶液中的电离方程式________。
(5)明矾常用作净水剂,结合相关理论解释其净水原理__________。
(6)用于治疗胃酸过多的药物还有多种,请写出其中一种的化学式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行硫酸铜晶体(![]() )结晶水含量的测定实验。完成下列填空:
)结晶水含量的测定实验。完成下列填空:
(实验步骤):
(1)在__________(填仪器名称)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入一定量的硫酸铜晶体,并称重。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至_______(填仪器名称)中冷却到室温,并称重。
(4)重复上述实验进行恒重操作,其目的是_______________,直到两次称量结果不超过______克。
(5)下面是该学生实验的一次数据,请完成计算:
坩埚质量(克) | 坩埚与晶体的质量(克) | 恒重后坩埚与固体质量 |
13.721 | 24.692 | 20.631 |
![]() ______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
(6)这次实验中产生误差的原因可能是_______
a. 硫酸铜晶体中含有不挥发性杂质 b. 在加热过程中发现有黑色物质生成
c. 加热时有晶体飞溅出来 d. 加热失水后露置在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两种物质无论以何种比例混合,只要混合的总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量均不变的是( )
A.C3H6、C3H8OB.C2H4、C2H6O
C.CH4O、C2H4O3D.C2H2、C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿克他利M(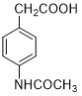 )是一种抗风湿性关节炎药物,其合成路线如下:
)是一种抗风湿性关节炎药物,其合成路线如下:

(1)反应1的类型为______________________________。
(2)反应2的试剂为______________________________。
(3)写出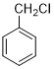 的所有含苯环结构的同分异构体的结构简式______________。
的所有含苯环结构的同分异构体的结构简式______________。
(4)写出由对硝基苯乙酸(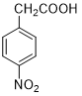 )得到对硝基苯乙酸乙酯的试剂和条件______。
)得到对硝基苯乙酸乙酯的试剂和条件______。
(5)A的分子式为C7H8,写出由A合成苯甲醛的合成路线。
(合成路线常用的表示方式为: )
)
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜晶体(CuSO4XH2O )中X值的实验过程如下:
![]()
(1)下列是实验中用到的几种仪器,仪器与对应名称正确的是___________。
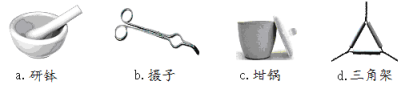
(2)“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是_____________________;“冷却”放在_______________中(填仪器名称)。
(3) “恒重”操作的目的是_________________________________________________;
判断“恒重”的依据是_________________________________________________。
(4)下面是某学生实验的一次数据,请完成计算
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.721g | 22.692g | 18.631g |
X=__________________;(精确到0.01),实验相对误差是_________________。(保留小数点后一位)
(5)这次实验中产生误差的原因可能是__________所造成的。
a.硫酸铜晶体中含有不挥发性杂质 b.在加热过程发现有黑色物质生成
c.加热时有晶体飞溅出来 d.加热失水后露置在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造.化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的镁铝合金(不含其它元素)中镁的质量分数,设计下列如下实验方案进行探究。填写下列空白:
(方案)将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________________________。
(2)用___________称取5.400 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥________mL。
(3)__________、洗涤、__________、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com