
【题目】将1.12 g铁粉加入到25 mL2 mol/L的氯化铁溶液中,充分反应后,其结果是
A.铁有剩余
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物与还原产物的物质的量之比为2:5
D.溶液中的Fe2+和Fe3+的物质的量之比为6:1
【答案】D
【解析】
铁粉的物质的量n(Fe)=![]() =0.02 mol,氯化铁的物质的量n(FeCl3)=c×V=2 mol/L×0.025 L=0.05 mol,Fe粉与FeCl3的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02 mol铁粉完全反应需要0.04 mol氯化铁,所以氯化铁剩余0.01 mol,生成的Fe2+的物质的量为0.06mol。
=0.02 mol,氯化铁的物质的量n(FeCl3)=c×V=2 mol/L×0.025 L=0.05 mol,Fe粉与FeCl3的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02 mol铁粉完全反应需要0.04 mol氯化铁,所以氯化铁剩余0.01 mol,生成的Fe2+的物质的量为0.06mol。
依据上述分析可知,
A. 氯化铁剩余,A错误;
B. 氯化铁剩余,向溶液中滴入无色KSCN溶液,显血红色,B错误;
C. 氧化产物与还原产物的物质的量之比是 1:2,C错误;
D. Fe2+的物质的量为0.06 mol,FeCl3的物质的量为0.01 mol,所以Fe2+和Fe3+的物质的量之比为0.06 mol:0.01 mol=6:1,D正确;
故合理选项是D。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】阿克他利M(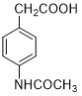 )是一种抗风湿性关节炎药物,其合成路线如下:
)是一种抗风湿性关节炎药物,其合成路线如下:

(1)反应1的类型为______________________________。
(2)反应2的试剂为______________________________。
(3)写出 的所有含苯环结构的同分异构体的结构简式______________。
的所有含苯环结构的同分异构体的结构简式______________。
(4)写出由对硝基苯乙酸(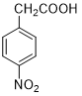 )得到对硝基苯乙酸乙酯的试剂和条件______。
)得到对硝基苯乙酸乙酯的试剂和条件______。
(5)A的分子式为C7H8,写出由A合成苯甲醛的合成路线。
(合成路线常用的表示方式为: )
)
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学试剂氨基氰(如图所示)常用于制备磺胺类药物,抗癌药等。下列有关氨基氰说法正确的是( )

A.属于不饱和烃B.分子中所有原子共面
C.水溶性较好D.能发生取代、加成、消去、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造.化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的镁铝合金(不含其它元素)中镁的质量分数,设计下列如下实验方案进行探究。填写下列空白:
(方案)将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________________________。
(2)用___________称取5.400 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥________mL。
(3)__________、洗涤、__________、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是
A.XY晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m![]() 6
6
C.X、Y可以属于同一周期,也可居于两个不同周期
D.X与Y一定不属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜与硫酸反应得硫酸铜。
(1)胆矾晶体结晶水含量测定实验中,恒重操作完成的标准是______________。
(2)利用如图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量如图下方的表格所示。

装置 | A(试管+粉末) | B | C |
反应前 | 50.0 g | 70.0 g | 540.0 g |
反应后 | 45.0 g | 74.5 g | 540.0 g |
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1molL-1的氨水,请回答以下问题:
(1)氨水呈碱性的原因为(用离子方程式表示)___。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式___;若所得溶液的pH=5,则溶液中水所电离出的氢离子浓度为___。
(3)若向氨水中加入少量硫酸铵固体,此时溶液中![]() __(填“增大”、“减小”或“不变”)。
__(填“增大”、“减小”或“不变”)。
(4)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amolL-1,则c(SO42-)=__。
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___。
(6)二氧化硫通入0.1mol/L的氯化钡溶液中至饱和,无现象,若继续加入氨水,产生白色沉淀,用电离平衡解释原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
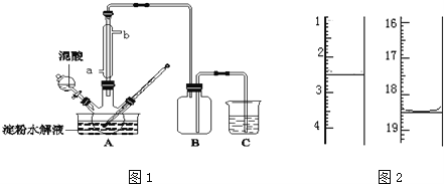
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com