
【题目】有机化学试剂氨基氰(如图所示)常用于制备磺胺类药物,抗癌药等。下列有关氨基氰说法正确的是( )

A.属于不饱和烃B.分子中所有原子共面
C.水溶性较好D.能发生取代、加成、消去、氧化等反应
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
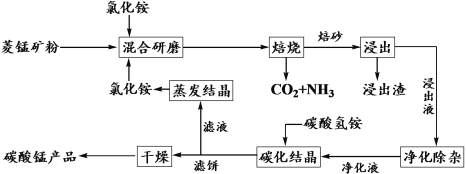
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时主要反应的化学方程式为__________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:_________________。

(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________________________;然后调节溶液pH使Fe3+、Al3+沉淀完全。
(4)碳化结晶时,发生反应的离子方程式为___________,碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,如:①硫酸亚铁片用于治疗贫血(下图是其说明书),②复方氢氧化铝用于治疗胃酸过多,③明矾用作净水剂,等等。

阅读上方“硫酸亚铁片”的标签说明,回答:
(1) “鉴别”中,“加稀盐酸1滴”的作用是_____________________________________;不是加稀硫酸的原因是_______________________________________。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝作为_________中和过多胃酸;氢氧化铝也能跟烧碱溶液反应,反应的离子方程式为_________________________。
(3)明矾能净水是因为①Al3+能水解,②水解产物氢氧化铝具有____________能力。设计一个简单实验验证明矾溶于水发生了水解__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-)=2:1,溶液中由水电离出的c(H+)=__。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2和H2充入一定体积的密闭容器中,反应过程和在两种温度下CH3OH的物质的量随时间的变化如图所示。
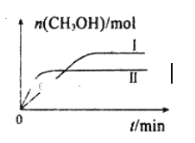
①已知图所示反应每消耗1molH2,热量变化是16.3kJ,则反应的热化学方程式为__。曲线I、Ⅱ对应的平衡常数大小关系为K1__K2(填“>”或“=”或“<”)。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是__。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H—H断裂
③一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
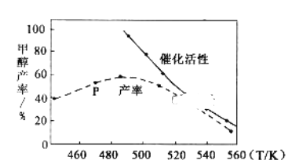
当温度为470K时,图中P点__(填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是__。
(3)用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,可能的机理如图所示。
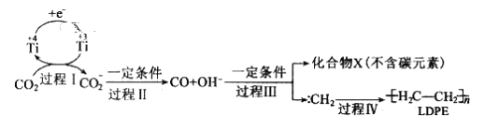
则过程I中阴极电极反应式__,工业上生产1.4×104g的LDPE,转移电子的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若规定碳12的相对原子质量为24,且将0.024千克碳12中所含的碳原子数目定义为阿伏伽德罗常数,则下列物理量数值会变为原来一半的是( )
A.一个碳12原子的质量B.98%硫酸的物质的量浓度
C.标况下气体摩尔体积D.44g干冰所含分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取相同质量的H2O和D2O分别与少量金属钾反应完全,若电子转移数目相同,则下列叙述中有关物理量不相等的是( )
A.反应消耗H2O和D2O的物质的量B.产生气体在相同条件下的体积
C.反应后所得溶液溶质的质量分数D.参加反应金属钾的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9.2g金属钠投入足量重水(D2O)中,则产生的气体中含有( )
A.0.2 mol中子B.0.2 mol质子C.0.4 mol电子D.0.4 mol分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL2 mol/L的氯化铁溶液中,充分反应后,其结果是
A.铁有剩余
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物与还原产物的物质的量之比为2:5
D.溶液中的Fe2+和Fe3+的物质的量之比为6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是化工生产重要原料甲叉琥珀酸的合成路线:

已知:R-Br+NaCN→R-CN+NaBr,R-CN![]() R-COONa+NH3↑,R-CCl3
R-COONa+NH3↑,R-CCl3![]() R-COONa+NaCl。
R-COONa+NaCl。
(1)已知A核磁共振氢谱中有两组吸收峰,且A不存在顺反异构,则A的名称为____。
(2)E的官能团名称为_____,B→C的反应类型是_____。
(3)写出下列过程的化学反应方程式:E→F:_____。
(4)写出符合下列条件的甲叉琥珀酸的同分异构体M的结构简式___。
①M可以使酸性高锰酸钾褪色
②1molM和足量的NaHCO3溶液反应,最多放出2molCO2
③核磁共振氢谱中只有三组吸收峰
(5)应用已学知识,以![]() 为原料设计合成
为原料设计合成![]() 的路线图(无机试剂任选)。____
的路线图(无机试剂任选)。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com