
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-)=2:1,溶液中由水电离出的c(H+)=__。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2和H2充入一定体积的密闭容器中,反应过程和在两种温度下CH3OH的物质的量随时间的变化如图所示。
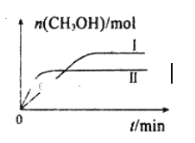
①已知图所示反应每消耗1molH2,热量变化是16.3kJ,则反应的热化学方程式为__。曲线I、Ⅱ对应的平衡常数大小关系为K1__K2(填“>”或“=”或“<”)。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是__。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H—H断裂
③一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
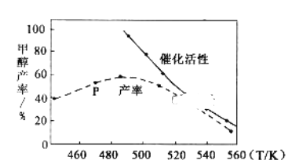
当温度为470K时,图中P点__(填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是__。
(3)用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,可能的机理如图所示。
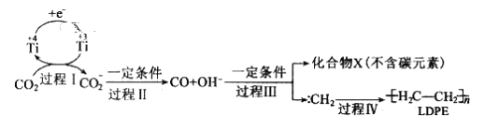
则过程I中阴极电极反应式__,工业上生产1.4×104g的LDPE,转移电子的物质的量为__。
【答案】10-4mol·L-1 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-48.9kJ·mol-1 > bd 不是 反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低 CO2+e-=CO2- 6×103mol
CH3OH(g)+H2O(g) ΔH=-48.9kJ·mol-1 > bd 不是 反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低 CO2+e-=CO2- 6×103mol
【解析】
(1)所得溶液![]() ,由
,由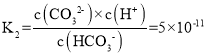 可知
可知![]() ,则c(OH)=10-4mol·L-1,则溶液中由水电离出的c(H+)=10-4mol·L-1;
,则c(OH)=10-4mol·L-1,则溶液中由水电离出的c(H+)=10-4mol·L-1;
故答案为: 10-4mol·L-1;
(2)①已知图1所示反应每消耗1molH2,热量变化是16.3KJ,涉及反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),消耗3mol氢气,则热量变化为48.9kJ,曲线I、Ⅱ中Ⅱ温度较高,可知升高温度甲醇物质的量较小,应为放热反应,则热化学方程式为CO2(g)+3H2(g)
CH3OH(g)+H2O(g),消耗3mol氢气,则热量变化为48.9kJ,曲线I、Ⅱ中Ⅱ温度较高,可知升高温度甲醇物质的量较小,应为放热反应,则热化学方程式为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-48.9kJ/mol,升高温度,平衡逆向移动,则平衡常数减小,K1>K2;
CH3OH(g)+H2O(g) △H=-48.9kJ/mol,升高温度,平衡逆向移动,则平衡常数减小,K1>K2;
故答案为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-48.9kJ·mol-1;>;
CH3OH(g)+H2O(g) ΔH=-48.9kJ·mol-1;>;
②a.反应在恒压条件下进行,无论是否达到平衡,容器中压强都不变,故a错误;b.H2的体积分数不变,可说明达到平衡状态,故b正确;c.平衡常数未知,且不能确定反应物转化的程度,c(H2)=3c(CH3OH)不能确定是否达到平衡状态,故c错误;d.反应前后体积不等,在恒压条件下,容器中密度不变,可说明达到平衡状态,故d正确;e.2个C=O断裂的同时有3个H-H断裂,都为正反应速率,不能说明正逆反应速率相等,故e错误;故答案为:bd;
③由于产率最高之前,未达到平衡状态,反应为放热反应,达到平衡之后,升高温度,平衡逆向移动,产率下降,且催化剂活性降低;
故答案为:不是;反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低;
(3)过程I中阴极电极发生还原反应生成![]() ,电极方程式为
,电极方程式为![]() ,由C原子守恒可知关系式为2nCO2~
,由C原子守恒可知关系式为2nCO2~![]() ,碳的化合价从+4变为-2,每个C原子得到6个电子,则2nCO2总共得到12n个电子,根据电荷守恒可得该电极反应式为:2nCO2+12e+12nH+=
,碳的化合价从+4变为-2,每个C原子得到6个电子,则2nCO2总共得到12n个电子,根据电荷守恒可得该电极反应式为:2nCO2+12e+12nH+=![]() +4nH2O,需要二氧化碳的物质的量为:
+4nH2O,需要二氧化碳的物质的量为:![]() ,则转移电子的物质的量为
,则转移电子的物质的量为![]() ;
;
故答案为:![]() ;6×103mol。
;6×103mol。


科目:高中化学 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
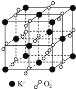
A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B. 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧与2价氧的数目比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿克他利M(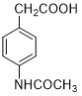 )是一种抗风湿性关节炎药物,其合成路线如下:
)是一种抗风湿性关节炎药物,其合成路线如下:

(1)反应1的类型为______________________________。
(2)反应2的试剂为______________________________。
(3)写出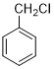 的所有含苯环结构的同分异构体的结构简式______________。
的所有含苯环结构的同分异构体的结构简式______________。
(4)写出由对硝基苯乙酸(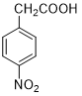 )得到对硝基苯乙酸乙酯的试剂和条件______。
)得到对硝基苯乙酸乙酯的试剂和条件______。
(5)A的分子式为C7H8,写出由A合成苯甲醛的合成路线。
(合成路线常用的表示方式为: )
)
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜晶体(CuSO4XH2O )中X值的实验过程如下:
![]()
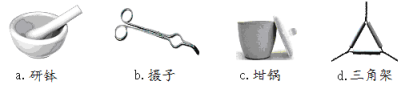
(1)下列是实验中用到的几种仪器,仪器与对应名称正确的是___________。
(2)“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是_____________________;“冷却”放在_______________中(填仪器名称)。
(3) “恒重”操作的目的是_________________________________________________;
判断“恒重”的依据是_________________________________________________。
(4)下面是某学生实验的一次数据,请完成计算
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.721g | 22.692g | 18.631g |
X=__________________;(精确到0.01),实验相对误差是_________________。(保留小数点后一位)
(5)这次实验中产生误差的原因可能是__________所造成的。
a.硫酸铜晶体中含有不挥发性杂质 b.在加热过程发现有黑色物质生成
c.加热时有晶体飞溅出来 d.加热失水后露置在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
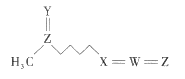
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A 经李比希法和质谱法分析得知其相对分子质量为 136,分子式为 C8H8O2。A 的核磁共振氢谱有 4 个峰且面积之比为 1:2:2:3,A 分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A 的下列说法中,正确的是( )
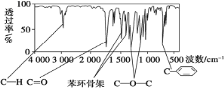
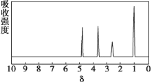
A.与 A 属于同类化合物的同分异构体只有 2 种
B.符合题中A 分子结构特征的有机物只有 1 种
C.A 分子属于酯类化合物,在一定条件下不能发生水解反应
D.A 在一定条件下可与 4molH2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学试剂氨基氰(如图所示)常用于制备磺胺类药物,抗癌药等。下列有关氨基氰说法正确的是( )

A.属于不饱和烃B.分子中所有原子共面
C.水溶性较好D.能发生取代、加成、消去、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造.化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的镁铝合金(不含其它元素)中镁的质量分数,设计下列如下实验方案进行探究。填写下列空白:
(方案)将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________________________。
(2)用___________称取5.400 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥________mL。
(3)__________、洗涤、__________、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com