
【题目】氧化铜与硫酸反应得硫酸铜。
(1)胆矾晶体结晶水含量测定实验中,恒重操作完成的标准是______________。
(2)利用如图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量如图下方的表格所示。

装置 | A(试管+粉末) | B | C |
反应前 | 50.0 g | 70.0 g | 540.0 g |
反应后 | 45.0 g | 74.5 g | 540.0 g |
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:_______________。
【答案】连续两次称量结果相差不超过0.001g 4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
【解析】
(1)恒重操作完成的标准是前后两次质量标准相差小于0.001 g;
(2)A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃,得出反应产物有氧化铜和氧气,根据氧化还原反应中得失电子相等,得出还原产物二氧化硫和氧气的物质的量之比为2:1,根据质量守恒定律来来计算产物硫的氧化物和氧气的质量比,进而确定三氧化硫的化学计量数,再根据硫原子守恒配平方程式。
(1)胆矾晶体结晶水含量测定实验中,要不断的对物质进行加热,分解,在干燥器中冷却至室温、然后称重,反复进行实验,恒重操作完成的标准是连续两次称量结果相差不超过0.001 g;
(2) A试管中对CuSO4进行加热,剩余黑色粉末为CuO,用带火星的木条伸入集气瓶D,发现木条能复燃,则有O2生成,根据氧化还原反应规律,则还原产物为SO2,根据氧化还原反应中得失电子相等,可知SO2和O2的物质的量之比为2:1,反应方程式可初步写成:CuSO4![]() CuO+xSO3↑+2SO2↑+O2↑,根据质量守恒定律分析,反应生成气体的质量为50.0 g-45.0 g=5.0 g,干燥管完全吸收了SO2和SO3,其质量为74.5 g-70 g=4.5 g,生成的O2的质量为5 g-4.5 g=0.5 g,则生成硫的氧化物和生成的O2的质量比为4.5 g:0.5 g=9:1,即(80x+2×64):32=9:1,解得:x=2,所以反应方程式可写出:CuSO4
CuO+xSO3↑+2SO2↑+O2↑,根据质量守恒定律分析,反应生成气体的质量为50.0 g-45.0 g=5.0 g,干燥管完全吸收了SO2和SO3,其质量为74.5 g-70 g=4.5 g,生成的O2的质量为5 g-4.5 g=0.5 g,则生成硫的氧化物和生成的O2的质量比为4.5 g:0.5 g=9:1,即(80x+2×64):32=9:1,解得:x=2,所以反应方程式可写出:CuSO4![]() CuO+2SO3↑+2SO2↑+O2↑,根据硫原子守恒配平得:4CuSO4
CuO+2SO3↑+2SO2↑+O2↑,根据硫原子守恒配平得:4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑。
4CuO+2SO3↑+2SO2↑+O2↑。


科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,其原理如图所示。下列有关说法错误的是( )
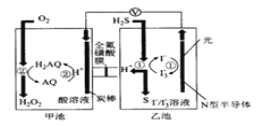
A.图中导线上标记方向为电子流向
B.装置中H+向甲池迁移
C.正极上的电极反应式为O2+4H++4e-=2H2O
D.乙池溶液中发生反应的离子方程式:H2S+I3- =3I-+S↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取相同质量的H2O和D2O分别与少量金属钾反应完全,若电子转移数目相同,则下列叙述中有关物理量不相等的是( )
A.反应消耗H2O和D2O的物质的量B.产生气体在相同条件下的体积
C.反应后所得溶液溶质的质量分数D.参加反应金属钾的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,甲、乙两烧杯均盛有5mLpH=3的醋酸溶液,向乙烧杯加水稀释至溶液pH=4,关于两烧杯中所得溶液的描述正确的是( )
A.溶液体积:10V甲<V乙
B.水电离出的OH-浓度:10c(OH-)甲 < c(OH-)乙
C.若分别用等物质的量浓度的NaOH溶液完全中和,所得溶液的pH:甲<乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL2 mol/L的氯化铁溶液中,充分反应后,其结果是
A.铁有剩余
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物与还原产物的物质的量之比为2:5
D.溶液中的Fe2+和Fe3+的物质的量之比为6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是
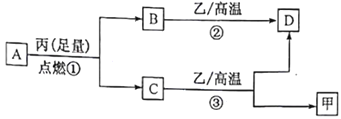
A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。乙醚浸取法的主要工艺如图所示:
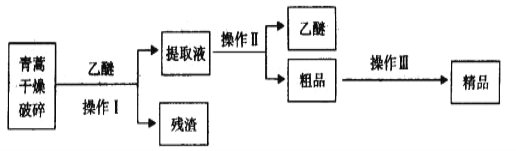
已知:青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。乙醚沸点为35℃。下列叙述错误的是( )
A.对青蒿干燥破碎后,加入乙醚的目的是溶解青蒿素
B.操作Ⅰ需要的玻璃仪器主要有烧杯、漏斗、玻璃棒
C.操作Ⅱ的名称是过滤
D.操作Ⅲ的主要过程可能是加95%的乙醇,浓缩、结晶、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态硼原子的价电子轨道表达式是_______________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________。
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的________。
(3)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______,写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH![]() 的键角是________,立体构型为___________。
的键角是________,立体构型为___________。
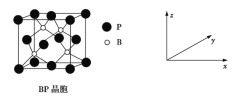
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______;已知晶胞边长为458 pm,则磷化硼晶体的密度是____g·cm-3(列式并计算,结果保留两位有效数字,已知4.583=96.07)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com