
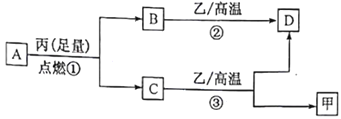
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是
A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
【答案】D
【解析】
A与C中均含有10个电子,A燃烧可生成C,由转化关系可知A应为CH4,丙为O2,B为CO2,C为H2O,B、C都可与乙在高温下反应,乙应为C,则D为CO,甲为H2,则X为H元素,Y为C元素,Z为O元素,以此解答该题。
由以上分析可知X为H元素,Y为C元素,Z为O元素,A为CH4,丙为O2,B为CO2,C为H2O,乙为C,D为CO,甲为H2。
A.由以上分析可知X为H元素,Y为C元素,Z为O元素,同周期元素从左到右原子半径逐渐减小,不同周期的元素,原子核外电子层数越多,原子半径越大,所以原子半径:Y>Z>X,A错误;
B.X为H元素,Y为C元素,二者形成的化合物,如CH4只含极性键,C2H6、C2H4等既含极性键,也含有非极性键,B错误;
C. Y为C元素,C元素有多种同素异形体,其中金刚石具有高熔点、高沸点、硬度大的性质,而石墨则质地软,C错误;
D.A 是CH4,C是H2O,元素的非金属性O>C,元素的非金属性越强,其最简单的氢化物的稳定性就越强,所以气态氢化物的稳定性A<C,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol气体A和2mol气体B通体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡态,此时剩余1.2molB,并测得C的浓为1.2mol·L-1。
xC(g)+2D(s),2min后反应达到平衡态,此时剩余1.2molB,并测得C的浓为1.2mol·L-1。
(1)从反应开始至达到平衡状态,生成C的平均应速率为_。
(2)x=__。
(3)下列各项可作为该反应达到平衡状态标志是_(填序号)。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香羧酸通常用芳香烃的氧化来制备,某同学用甲苯的氧化反应制备苯甲酸。已知:![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
反应试剂、产物的物理常数:
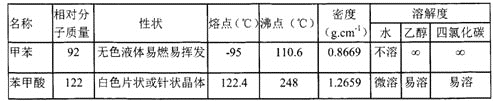
主要实验装置和流程如下:
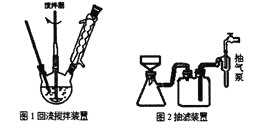
实验方法:向图1装置中依次加入2.8mL甲苯、200mL水和8.6g高锰酸钾,通冷凝水,加热至沸腾,在反应过程中,甲苯不断的被冷凝回流,反应结束后,按以下步骤操作,得到苯甲酸粗产品。
![]()
(1)图1装置中反应结束的标志是__,趁热抽滤的目的是__。
(2)写出浓盐酸酸化时的所有离子反应方程式__。
(3)下列说法正确的是__。
A.图1装置中的反应混合物抽滤时应用玻璃砂漏斗替代布氏漏斗
B.在冷却抽滤时,若有产品黏在瓶壁上,可用滤液淋洗,直到所有晶体收集到布氏漏斗中,再次抽滤
C.苯甲酸粗产品的杂质除KCl外还可能含有甲苯,均可用蒸馏水洗涤除去
D.抽滤结束,为防止倒吸,应先关闭水龙头,再拆掉抽气泵和吸滤瓶之间的橡皮管
(4)苯甲酸纯度测定:用__(填仪器名称)称取1.220g产品,加合适溶剂溶解,再用蒸馏水稀释配成100mL溶液,取25.00mL溶液,滴加几滴指示剂,用0.1000molL-1NaOH标准液进行滴定,平行滴定3次,平均消耗标准液体积为21.00mL
①“合适溶剂”和“指示剂”分别为__。
A.蒸馏水和酚酞 B.乙醇和甲基橙 C.四氯化碳和酚酞 D.乙醇和酚酞
②苯甲酸产品的纯度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺(又名氨基苯)是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4![]() +9Fe+4H2O
+9Fe+4H2O![]() 4
4![]() +3Fe3O4
+3Fe3O4
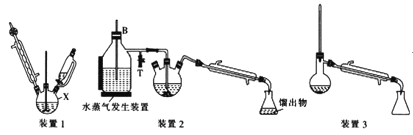
已知部分有机物的一些数据如下表:
名称 | 密度(gmL-1) | 熔点(℃) | 沸点(℃) | 溶解性 | 备注 |
硝基苯 | 1.2037 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 | |
苯胺 | 1.0217 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 | 空气中易变质 |
乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
Ⅰ.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸3~5min后冷却至室温,再将7.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为__。
(2)仪器X的名称是__;加入硝基苯时,“逐滴加入span>”的目的是__。
(3)分离提纯过程中加入NaCl固体的作用是__。
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是__;装置2中长导管B的作用是__。
(5)萃取分液操作过程中要远离明火和热源,原因是__。
(6)温度T的范围为__,实验结束得到6.0mL产物,则苯胺的产率为__(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是 {已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
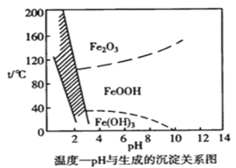
A.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
B.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
C.用氯酸钠在酸性条件下氧化Fe2+ 离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
D.在25℃时溶液经氧化,调节溶液pH=4 ,此时溶液中c(Fe3+)=2.64×10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:![]() 。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4
。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4![]() 、0.2
、0.2![]() 、0.4
、0.4![]() ,当反应达到平衡时,可能存在的数据是( )
,当反应达到平衡时,可能存在的数据是( )
A. SO2的浓度为0.8![]() ,O2为0.4
,O2为0.4![]() B. SO2的浓度为0.5
B. SO2的浓度为0.5![]()
C. SO3的浓度为0.8![]() D. SO2、SO3的浓度一定均为0.3
D. SO2、SO3的浓度一定均为0.3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸银是一种无色晶体,易溶于水。用于照相乳剂、镀银、制镜、印刷、医药、染毛发等,也用于电子工业。硝酸银不稳定,易发生如下反应:
①2AgNO3(s)=2Ag(s)+ 2NO2(g)+O2(g) △H1>0
②2NO2(g) ![]() N2O4(g) △H2<0
N2O4(g) △H2<0
(1)实验室配制硝酸银溶液的方法是:将一定量硝酸银固体溶于浓硝酸中,加水稀释至指定体积。“硝酸”的作用是___________________。
(2)2AgNO3(s) =2Ag(s)+N2O4(g)+O2(g) △H=______________ (用含△H1、△H2的式子表示)。
(3)温度T1时,在0.5L的恒容密闭容器中投入3.4 g AgNO3(s)并完全分解测得混合气体的总物质的量(n)与时间(t)的关系如图所示。
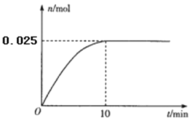
①下列情况能说明体系达到平衡状态的是_________(填字母)
a.固体质量不再改变 b.O2的浓度不再改变
c.NO2的体积分数不再改变 d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0. 3MPa。反应开始到
10min内N2O4的平均反应速率为___________ MPa·min-1。在该温度下2NO2(g)![]() N2O4(g)的平衡常数Kp=___________(MPa)-1(结果保留2位小数)。
N2O4(g)的平衡常数Kp=___________(MPa)-1(结果保留2位小数)。
[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1) =平衡时总压(p)×该组分的体积分数(![]() )]
)]
③实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=2υ(N2O4) 消耗=k逆c(N2O4),k正、k逆为速率常数只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1______T2(填“>”、“<”或“=")
(4)NO与O2反应生成NO2的反应历程为:第一步NO+NO![]() N2O2 (快速平衡)
N2O2 (快速平衡)
第二步N2O2+O2=2NO2 (慢反应),下列叙述正确的是___________(填标号)。
A. υ(第一步的正反应) <υ(第二步的反应) B.总反应快慢由第二步决定
C. 第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )

A.反应进行的前3min内,用X表示的反应速率v(X)=0.3mol/(L·min)
B.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com