
【题目】室温下,甲、乙两烧杯均盛有5mLpH=3的醋酸溶液,向乙烧杯加水稀释至溶液pH=4,关于两烧杯中所得溶液的描述正确的是( )
A.溶液体积:10V甲<V乙
B.水电离出的OH-浓度:10c(OH-)甲 < c(OH-)乙
C.若分别用等物质的量浓度的NaOH溶液完全中和,所得溶液的pH:甲<乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲<乙
【答案】AD
【解析】
A.醋酸为弱酸,加水稀释时,促进醋酸的电离,电离产生的氢离子增多,要使pH仍然为4,加入的水应该多一些,所以10V甲<V乙,故A正确;
B.醋酸溶液中的氢氧根离子是水电离出来的,则pH=3的醋酸中,水电离的氢氧根离子浓度为c(OH)甲=![]() =1011mol/L,pH=4的醋酸中,水电离的氢氧根离子浓度为c(OH)乙=
=1011mol/L,pH=4的醋酸中,水电离的氢氧根离子浓度为c(OH)乙=![]() =1010mol/L,则10 c(OH)甲=c(OH)乙,故B错误;
=1010mol/L,则10 c(OH)甲=c(OH)乙,故B错误;
C.稀释前后甲乙两个烧杯中所含的醋酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,由于醋酸是弱酸,则甲溶液水解导致的pH大于乙,即:甲>乙,故C错误;
D.由于醋酸是弱酸,则反应后醋酸有剩余,甲中剩余酸浓度大,酸性强,pH小,所得溶液的pH:甲<乙,故D正确;
故答案选AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组中两种物质无论以何种比例混合,只要混合的总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量均不变的是( )
A.C3H6、C3H8OB.C2H4、C2H6O
C.CH4O、C2H4O3D.C2H2、C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A 经李比希法和质谱法分析得知其相对分子质量为 136,分子式为 C8H8O2。A 的核磁共振氢谱有 4 个峰且面积之比为 1:2:2:3,A 分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A 的下列说法中,正确的是( )
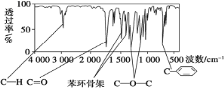
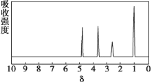
A.与 A 属于同类化合物的同分异构体只有 2 种
B.符合题中A 分子结构特征的有机物只有 1 种
C.A 分子属于酯类化合物,在一定条件下不能发生水解反应
D.A 在一定条件下可与 4molH2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品防腐剂J 的合成路线如下:
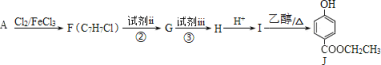
请回答下列问题:
(1)A 属于芳香烃,其结构简式是_____,H 的结构简式是_______。
(2) 反应②、③中试剂 ii 和试剂 iii 依次是_______。(填序号)
a 高锰酸钾酸性溶液、氢氧化钠溶液 b 氢氧化钠溶液、高锰酸钾酸性溶液
(3)J 有多种同分异构体:其中符合下列条件的同分异构体有_______种,写出符合下列条件、且核磁共振氢谱有 6 组峰的同分异构体的结构简式:_______。
a 为苯的二元取代物,且遇 FeCl3 溶液显紫色
b 与J 具有相同的官能团,且能发生银镜反应
(4)以 A 为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(![]() ),写出合成路线_____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
),写出合成路线_____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
例如:由氯乙烷制备 1,2-二溴乙烷的合成路线:CH3CH2Cl![]() CH2CH2
CH2CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造.化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的镁铝合金(不含其它元素)中镁的质量分数,设计下列如下实验方案进行探究。填写下列空白:
(方案)将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________________________。
(2)用___________称取5.400 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥________mL。
(3)__________、洗涤、__________、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碳酸钠样品中可能含有氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜五种杂质中的三种。现进行下列实验:
①称取4.7g 样品,加入足量水,样品部分溶解。
②向①中所得悬浊液中加入100mL1 mol/LHCl,最终得到无色澄清溶液, 此过程中共产生0.04 mol气体。
③向②中反应后溶液中加入足量的硝酸银与稀硝酸,得到15.8g白色沉淀,
由此可知杂质中( )
A.一定含NaCl,一定不含CuSO4B.可能含CaO、NaOH
C.一定含CaCO3,可能含NaOHD.可能含CaO而不含CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜与硫酸反应得硫酸铜。
(1)胆矾晶体结晶水含量测定实验中,恒重操作完成的标准是______________。
(2)利用如图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量如图下方的表格所示。

装置 | A(试管+粉末) | B | C |
反应前 | 50.0 g | 70.0 g | 540.0 g |
反应后 | 45.0 g | 74.5 g | 540.0 g |
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
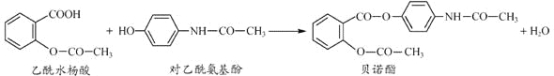
下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交警用三氧化铬(CrO3)硅胶可以查酒驾。元素Cr的几种化合物转化关系如图所示,下列判断正确的是
CrO3固体![]() K2CrO4溶液
K2CrO4溶液![]() K2Cr2O7溶液
K2Cr2O7溶液![]() CrO2Cl2+COCl2
CrO2Cl2+COCl2
A.反应①表明CrO3有酸性氧化物的性质
B.CrO42-在碱性溶液中不能大量存在
C.只有反应③为氧化还原反应
D.基态铬原子的价电子排布式为3d44s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com