
【题目】食品防腐剂J 的合成路线如下:
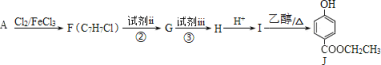
请回答下列问题:
(1)A 属于芳香烃,其结构简式是_____,H 的结构简式是_______。
(2) 反应②、③中试剂 ii 和试剂 iii 依次是_______。(填序号)
a 高锰酸钾酸性溶液、氢氧化钠溶液 b 氢氧化钠溶液、高锰酸钾酸性溶液
(3)J 有多种同分异构体:其中符合下列条件的同分异构体有_______种,写出符合下列条件、且核磁共振氢谱有 6 组峰的同分异构体的结构简式:_______。
a 为苯的二元取代物,且遇 FeCl3 溶液显紫色
b 与J 具有相同的官能团,且能发生银镜反应
(4)以 A 为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(![]() ),写出合成路线_____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
),写出合成路线_____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
例如:由氯乙烷制备 1,2-二溴乙烷的合成路线:CH3CH2Cl![]() CH2CH2
CH2CH2![]() CH2BrCH2Br
CH2BrCH2Br
【答案】![]()
![]() a 6
a 6 ![]() 、
、![]()
![]()
【解析】
分析流程,突破口为F(C7H7Cl),A为芳香烃,在Cl2/FeCl3条件下发生苯环上的卤代生成F,则A应为C7H8,所以A为![]() ,F为
,F为![]() ,J中含有酯基,为羧基与羟基反应而来,表明流程中反应会生成羧基,则试剂ii为酸性高锰酸钾溶液,甲基被反应为羧基,则G为
,J中含有酯基,为羧基与羟基反应而来,表明流程中反应会生成羧基,则试剂ii为酸性高锰酸钾溶液,甲基被反应为羧基,则G为![]() ,J中含有酚羟基,应由Cl为-OH取代得到,则试iii为氢氧化钠溶液,则H为
,J中含有酚羟基,应由Cl为-OH取代得到,则试iii为氢氧化钠溶液,则H为![]() ,经过酸化,得到I,则I为
,经过酸化,得到I,则I为![]() ,以此解答本题。
,以此解答本题。
(1)由上述分析可知,A为![]() ;H的结构简式为
;H的结构简式为![]() ;
;
(2)由上述分析,反应②、③中试剂ii和试剂iii依次是酸性高锰酸钾溶液、氢氧化钠溶液,故答案为:a;
(3)J为: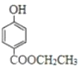 ,有多种同分异构体,其中符合a.为苯的二元取代物,遇FeCl3溶液显紫色,说明含有酚羟基,b.与J具有相同的官能团,且能发生银镜反应,说明含有醛基,符合结构的同分异构体有:
,有多种同分异构体,其中符合a.为苯的二元取代物,遇FeCl3溶液显紫色,说明含有酚羟基,b.与J具有相同的官能团,且能发生银镜反应,说明含有醛基,符合结构的同分异构体有:![]() 、
、![]() 、
、![]() 、
、 、
、![]() 、
、![]() ,共有6种;其中核磁共振氢谱有6组峰的同分异构体为:
,共有6种;其中核磁共振氢谱有6组峰的同分异构体为:![]() 、
、![]() ;
;
(4)A为:![]() ,以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(
,以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(![]() ),根据结构简式可知,需要将苯基转化为环己烷基,目标产物中含有碳碳双键,可通过消去反应生成,可考虑如下流程:
),根据结构简式可知,需要将苯基转化为环己烷基,目标产物中含有碳碳双键,可通过消去反应生成,可考虑如下流程:![]() 。
。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空:
N | O | F | |||||
Mg | Al | S | Cl | ||||
(1)N元素形成的单质的电子式_________;N元素的气态氢化物含有化学键属于_______(“离子键”或“共价键”)。
(2)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实(用文字描述)___________
(3)S和Cl中,非金属性较强的是___________(写元素符号),不能说明该结论的事实是________(填字母符号)。
a. 单质硫难溶于水,氯气能溶于水
b. ![]() 通入
通入![]() 溶液中,溶液变浑浊
溶液中,溶液变浑浊
c. 受热时![]() 易分解,HCl不易分解
易分解,HCl不易分解
d. 氯气与铁反应生成![]() ,硫与铁反应生成FeS
,硫与铁反应生成FeS
(4)O和S中,非金属性较强的是_________(写元素符号),写出能说明该结论的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制汞的方法之一是辰砂(主要含HgS)焙烧法,焙烧辰砂时发生的主要反应为HgS+O2![]() Hg+SO2,生成的汞为气态,冷凝得液态汞。一种利用辰砂制备纯汞的流程如图所示。下列分析正确的是( )
Hg+SO2,生成的汞为气态,冷凝得液态汞。一种利用辰砂制备纯汞的流程如图所示。下列分析正确的是( )
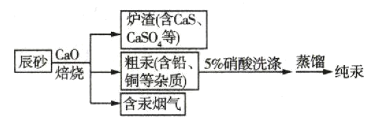
A.焙烧时加入CaO的主要目的是降低HgS的熔点
B.含汞烟气需除汞后才能排放到大气中
C.用5%的硝酸洗涤时发生的是物理变化
D.在实验室中进行蒸馏操作需要蒸馏烧瓶、冷凝管和分液漏斗等仪器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中一定不存在同分异构体的是( )
A.CH2=CHCH3 与HBrB.![]() 与NaOH 乙醇溶液共热
与NaOH 乙醇溶液共热
C.1,3-丁二烯与溴以 1:1 反应D.![]() 与NaHCO3 溶液
与NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取相同质量的H2O和D2O分别与少量金属钾反应完全,若电子转移数目相同,则下列叙述中有关物理量不相等的是( )
A.反应消耗H2O和D2O的物质的量B.产生气体在相同条件下的体积
C.反应后所得溶液溶质的质量分数D.参加反应金属钾的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外
A.①③④B.②⑤C.②③⑤D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,甲、乙两烧杯均盛有5mLpH=3的醋酸溶液,向乙烧杯加水稀释至溶液pH=4,关于两烧杯中所得溶液的描述正确的是( )
A.溶液体积:10V甲<V乙
B.水电离出的OH-浓度:10c(OH-)甲 < c(OH-)乙
C.若分别用等物质的量浓度的NaOH溶液完全中和,所得溶液的pH:甲<乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是
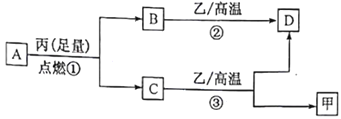
A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案:测定某含有NaCl的小苏打样品中![]() 的质量分数。已知:
的质量分数。已知:![]() 受热分解成碳酸钠、二氧化碳和水。
受热分解成碳酸钠、二氧化碳和水。
(方案一)称取一定质量样品,置于仪器A中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)仪器A的名称为___________;A应该放在_________中冷却。恒重操作的目的是________。
(2)本实验从称量空的A仪器开始,完成一次平行实验至少需要称重____次。做平行实验的目的是___________。
(方案二)称取一定质量的样品(样品的质量为m0),置于小烧杯中,加适量水溶解;向小烧杯中加入足量澄清石灰水,过滤,洗涤、干燥,称量沉淀的质量为m1,计算。(已知碳酸钙式量为100,![]() 的式量为84)。
的式量为84)。
(3)反应方程式为_____________,则样品中![]() 的质量分数可以表示为_________。
的质量分数可以表示为_________。
(方案三)往Y形管中注入一定体积和浓度的稀硫酸并放入准确称取的ag样品,连接好注射器(如图),再将Y形管倾斜,使样品与酸液充分反应。
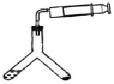
(4)a不能太大,理由是___________,若测定结果偏高,其原因可能是______(选填序号)。
①样品未完全反应
②温度未恒定即记录数据
③少量![]() 溶解在溶液中
溶解在溶液中
(方案四)称取一定质量样品,配成待测溶液,用标准盐酸滴定。
(5)下列叙述正确的是_______(选填序号)。
①用烧杯配制100mL待测溶液
②用酚酞为指示剂
③当滴至待测液变色并能将该颜色保持半分钟即为滴定终点
④盛盐酸的滴定管未润洗会造成实验结果偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com