
【题目】在电解水制取H2和O2时,为了增强导电性常常要加入一些电解质,最好选用
A.NaOH B.HCl C.NaCl D.CuSO4
科目:高中化学 来源: 题型:
【题目】根据海水综合利用的工业流程图(如图),判断下列说法正确的是:
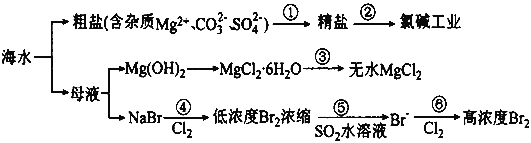
A.过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质
B.在过程③中将MgCl2·6H2O真接灼烧即可制得纯净无水MgCl2
C.过程⑥所得的高浓度溴水只需分液即可获得液溴
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。
(1)在一定温度下,将足量SO2气体通入甲酸(HCOOH)和NaOH混合溶液中,即有保险粉生成同时生成一种气体。该反应的化学方程式为_________________________。
(2)保险粉可用于除去废水中的重铬酸根离子(Cr2O72﹣被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,则每消耗0.2mol保险粉,理论上可除去Cr2O72﹣的物质的量为__________mol
(3)Na2S2O4溶液在空气中易被氧化,某课题小组测定0.050mol·L﹣1Na2S2O4溶液在空气pH变化如下图1;
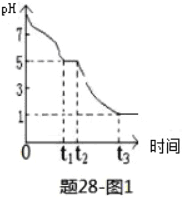

①0-t1段主要生成HSO3﹣,根据pH变化图,推测0-t1发生反应的离子方程式为_______________;
②t3时溶液中主要阴离子是_________,t2-t3阶段pH变小的主要原因是______________________。
③若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32﹣)—c(H2SO3)=___mol·L﹣1(填准确值,不考虑溶液体积变化)。
(4)利用图2所示装置(电极均为惰性电极)也可使NaHSO3转化为Na2S2O4,并获得较浓的硫酸。
①a为电源的________(填“正极”或“负极”);
②阴极的电极反应式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色电源“二甲醚【(CH3)2O】﹣氧气燃料电池”的工作原理如图所示,下列说法正确的是( ) 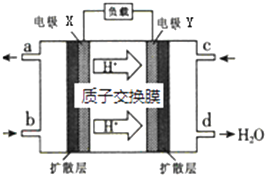
A.氧气应从c处通入,电极Y上发生的反应为:O2+4e﹣+2H2O═4OH﹣
B.电池在放电过程中,电极X周围溶液的pH增大
C.当该电池向外电路提供2 mol电子时消耗O2约为11.2L
D.二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O﹣12e﹣+3H2O═2CO2+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组顺序的排列不正确的是( )
A. 金属性:Na<Mg<Al B. 热稳定性:HCl>H2S>PH3
C. 酸性强弱:H4SiO4<H3PO4<HClO4 D. 原子半径大小:Na>S>Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 , 仍存在的缺陷是 . 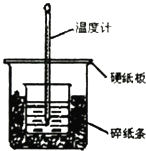
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1 , 则△H1与△H的关系为:△H1△H(填“<”、“>”或“=”).
(3)写出该反应的中和热的热化学方程式(中和热为57.3kJ/mol): .
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,装置已做改进.实验数据如表.
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
又已知0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都近似为1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把H2SO4溶液倒入盛有NaOH溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后未清洗直接测定H2SO4溶液的温度
e.实验当天气温较高.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索生命现象中的有关微观变化,科学家常以 ![]() C标记的化合物为示踪剂,下列关于
C标记的化合物为示踪剂,下列关于 ![]() C的说法中正确的是( )
C的说法中正确的是( )
A.质量数是6
B.质子数是6
C.电子数是14
D.中子数是14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() N2O2(g)(快) △H1<0平衡常数K1
N2O2(g)(快) △H1<0平衡常数K1
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) △H2<0平衡常数K2
2NO2(g)(慢) △H2<0平衡常数K2

下列说法正确的是( )
A. 2NO(g)+O2(g)![]() 2NO2(g)的△H=-(△H1+△H2)
2NO2(g)的△H=-(△H1+△H2)
B. 2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K= K1/K2
2NO2(g)的平衡常数K= K1/K2
C. 反应②的速率大小决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
D. 反应过程中的能量变化可用图a表示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com