
【题目】为探索生命现象中的有关微观变化,科学家常以 ![]() C标记的化合物为示踪剂,下列关于
C标记的化合物为示踪剂,下列关于 ![]() C的说法中正确的是( )
C的说法中正确的是( )
A.质量数是6
B.质子数是6
C.电子数是14
D.中子数是14
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A. 氢气的燃烧热为285.5 kJ/mol,则水电解的热化学方程式为:
2H2O(l) =2H2(g)+O2(g) △H=+285.5 kJ/mol
B. lmol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为:
![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) △H=-445 kJ/mol
CO2(g)+H2O(l) △H=-445 kJ/mol
C. 己知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1,则C(S)的燃烧热为-110.5kJ/mol
D. HF与NaOH 溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) △H =-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为______________。
(2)将1.0molCH4和2.0molH2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如下图。
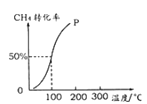
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为_______。
(3)在压强为0.1MPa、温度为300℃条件下,将amolCO与3amol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的![]() ,其他条件不变,对平衡体系产生的影响是__________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是__________(填字母序号)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡![]() 减小 E.平衡常数K增大
减小 E.平衡常数K增大
(4)1mol甲醇完全燃烧产生气体通入1L1.5mol/L的NaOH溶液反应,反应后的溶液中各离子浓度大小关系为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种试剂:①新制氢氧化铜悬浊液;②浓硝酸;③硝酸银溶液;④碘水。为了鉴别葡萄糖、淀粉、食盐、鸡蛋清四瓶无色溶液,分别选择合适的试剂,正确的顺序是()。
A. ①②③④ B. ④①②③ C. ①④②③ D. ①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种溶液分别是氢氧化钡溶液、氨水、醋酸溶液、盐酸中的一种。
已知同浓度的四种溶液:①加入大小完全相同的镁条,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(1)D溶液为_______________;同浓度的四种溶液中,pH值最大的是______________(填化学式)溶液。
(2)pH值和体积均相同的A和C溶液,分别与足量大小完全相同的锌粒反应,开始时的反应速率
v(A)______________v(C) (填“>”“<”或“=”)
(3)等体积等浓度的氨水和盐酸混合后,所得溶液呈______________(填“酸性”、“碱性”或“中性”),用离子方程式解释其原因__________________________________。
(4)常温下,2mol/L的NaOH溶液与amol/L的醋酸溶液等体积混合后,发现溶液呈中性,
试计算:该温度下醋酸钠的水解平衡常数Kb=________________(用含a的代数式表示。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各原子或离子的电子排布式错误的是( )
A.Na:1s22s22p63s1B.F:1s22s22p5
C.N3:1s22s22p6D.O2:1s22s22p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护考虑,大量制取Cu(NO3)2最宜采用的方法是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() ?CuO
?CuO ![]() Cu(NO3)2
Cu(NO3)2
D.Cu ![]() CuCl2
CuCl2 ![]() ?Cu(NO3)2
?Cu(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com