
����Ŀ��������������(Na2S2O4)�׳Ʊ��շۣ���һ��ǿ��ԭ�����㷺���ڷ�֯��ҵ��
��1����һ���¶��£�������SO2����ͨ�����(HCOOH)��NaOH�����Һ�У����б��շ�����ͬʱ����һ�����塣�÷�Ӧ�Ļ�ѧ����ʽΪ_________________________��
��2�����շۿ����ڳ�ȥ��ˮ�е��ظ��������(Cr2O72����ת��ΪCr3+)������Ŀǰ��ȥ���Է�ˮ�и����ӵ���Ч����֮һ����ÿ����0.2mol���շۣ������Ͽɳ�ȥCr2O72�������ʵ���Ϊ__________mol
��3��Na2S2O4��Һ�ڿ������ױ�������ij����С��ⶨ0.050mol��L��1Na2S2O4��Һ�ڿ���pH�仯����ͼ1��
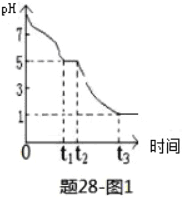

��0-t1����Ҫ����HSO3��������pH�仯ͼ���Ʋ�0-t1������Ӧ�����ӷ���ʽΪ_______________��
��t3ʱ��Һ����Ҫ��������_________��t2-t3��pH��С����Ҫԭ����______________________��
����t1ʱ��Һ��Na2S2O4ȫ����������NaHSO3����ʱ��Һ��c(SO32��)��c(H2SO3)=___mol��L��1(��ȷֵ����������Һ����仯)��
��4������ͼ2��ʾװ��(�缫��Ϊ���Ե缫)Ҳ��ʹNaHSO3ת��ΪNa2S2O4������ý�Ũ�����ᡣ
��aΪ��Դ��________(��������������������)��
�������ĵ缫��ӦʽΪ_____________________��
���𰸡���1��NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O����2��0.2����3����2S2O42-+O2+2H2O=4HSO3-����SO42-��HSO4-��HSO3-�������е���������������������Һ��������Ũ����������4������������2HSO3-+2H++2e- = S2O42-+2H2O��
��������
�����������1��SO2����ͨ������Ƶļ�����Һ��������Na2S2O4����Ӧ�Ļ�ѧ����ʽΪNaOH + HCOONa +2SO2 = Na2S2O4 + CO2 + H2O��
��2�����ݵ��ӵ�ʧ�غ��֪�����շ����ظ�������ӷ�Ӧ�Ĺ�ϵʽΪCr2O72-��Na2S2O4������ÿ����0.2mol���շ��������Ͽ��Գ�ȥCr2O72-�����ʵ���Ϊ0.2mol���ʴ�Ϊ��0.2��
��3����0��t1����Ҫ������HSO3-����Һ��������˵��HSO3-�ĵ���̶ȴ���ˮ��̶���Na2S2O4��Һ�ڿ������ױ���������������������0��t1 �������ӷ�Ӧ����ʽΪ��2S2O42-+O2+2H2O=4HSO3-���ʴ�Ϊ��2+O2+2H2O=4HSO3-��
��t3ʱ��Һ��pH=1��˵����Һ�����Խ�ǿ��������������Ʊ�����Ϊ�������ƣ�����Һ����Ҫ�����ӷ�����SO42-��HSO4-��t2-t3��pH��С����Ҫ����ΪHSO3-�������е����������������ᣬ��Һ��������Ũ������pH��С���ʴ�Ϊ��SO42-��HSO4-��HSO3-�������е����������������ᣬ��Һ��������Ũ������
��4�� �����Դa�缫�����ĵ缫�϶�����������Ϊ���ᣬ����������Ӧ���õ缫Ϊ���ص���������aΪ��Դ���������ʴ�Ϊ���������������Ϸ�����ԭ��Ӧ�����������Ʊ���ԭΪNa2S2O4���缫��ӦʽΪ2HSO3-+2H++2e- = S2O42-+2H2O�� �ʴ�Ϊ��2HSO3-+2H++2e- = S2O42-+2H2O��


 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2L���ܱ�������Ͷ��һ����M��N���з�Ӧ��M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ�� 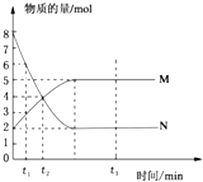
��1��д���˷�Ӧ�Ļ�ѧ����ʽ
��2��������������˵��������Ӧ�ﵽƽ��״̬���� ��
A.��Ӧ��M��N�����ʵ���֮��Ϊ1��1
B.�ڻ��������N�������ٷ������ֲ���
C.��������ƽ��Ħ����������ʱ��ı仯���仯
D.��������ѹǿ����ʱ��ı仯���仯
��3����t3=3����3min����M��ʾ�ķ�Ӧ������
��4����t2ʱ������Ӧ����v���������淴Ӧ����v���棩�Ĵ�С��ϵ�� ��
��5����Ӧ�ﵽƽ���N��ռ�����������������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ��4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g)������Ϊ���ֲ�ͬ����²�õķ�Ӧ�����������ܱ����÷�Ӧ����������
4NO(g) + 6H2O(g)������Ϊ���ֲ�ͬ����²�õķ�Ӧ�����������ܱ����÷�Ӧ����������
A. v(O2)= 0.24 mol��L-1��s-1 B. v(NH3)=0.2 mol��L-1��s-1
C. v(H2O)=0.25 mol��L-1��s-1 D. v(NO) = 0.15 mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У������γ�ԭ��ط�Ӧ���ǣ� ��
A.�������������ᷴӦ
B.����п��ϡ���ᷴӦ
C.����ȼ��
D.����ͭ�����Ȼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͭ��Ũ���ᷴӦ��ȡ����ͭ��ʵ��װ����ͼ��ʾ��
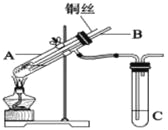
A��װ��������Ũ�������Щ���ʣ�______��
��2��Ϊ������ɫ��ѧ��Ҫ��ijͬѧ����������ƣ���ͭ����______�����������ƣ��з������գ�ʹͭ�������ַ�Ӧ��������ͭ���ٽ�����ͭ��ϡ���ᷴӦ����Ӧ����Һ����______��______�����ˡ�ϴ�ӡ�������ɵõ���ƷCuSO45H2O���壬����ʱ��Ҫ�����¶�С��100�棬���¶ȹ��ߣ���ᵼ��______��
��3��̽��С���õζ����ⶨij����������CuSO4�ĺ�����ȡag��Ʒ���100mL��Һ��ÿ��ȡ20.00mL�������������Ӻ���c molL��1��EDTA��H2Y2��������Һ�ζ����յ㣬ƽ������EDTA��Һ6mL���ζ���Ӧ���£�Cu2++H2Y2��=CuY2��+2H+��
��д������CuSO4���������ļ���ʽ��=______��
�����в����ᵼ��CuSO4�����IJⶨ���ƫ�͵���______��
a������Ʒ��Һ��ϴ��ƿ
b���ζ��յ�ʱ���Ӷ���
c���ζ��յ�ʱ�ζ��ܼ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ����������ȷ����
A. ������ȼ����Ϊ285.5 kJ/mol����ˮ�����Ȼ�ѧ����ʽΪ��
2H2O(l) =2H2(g)+O2(g) ��H=+285.5 kJ/mol
B. lmol������ȫȼ������CO2��H2O(l)ʱ�ų�890 kJ�����������Ȼ�ѧ����ʽΪ��
![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) ��H=-445 kJ/mol
CO2(g)+H2O(l) ��H=-445 kJ/mol
C. ��֪2C(s)+O2(g)=2CO(g) ��H=-221 kJ��mol-1����C(S)��ȼ����Ϊ-110.5kJ/mol
D. HF��NaOH ��Һ��Ӧ��H+(aq)+OH-(aq)=H2O(l) ��H=-57.3 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ��ˮ��ȡH2��O2ʱ��Ϊ����ǿ�����Գ���Ҫ����һЩ����ʣ����ѡ��
A��NaOH B��HCl C��NaCl D��CuSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ԭ�ӻ����ӵĵ����Ų�ʽ�������( )
A.Na��1s22s22p63s1B.F��1s22s22p5
C.N3��1s22s22p6D.O2��1s22s22p4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com