
【题目】下列关于各实验装置的叙述正确的是( )
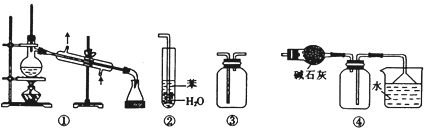
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②用于吸收NH3或HCl气体时,易形成倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3、C2H4等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
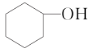
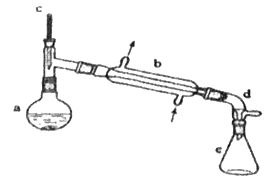
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()
![]() +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________________。
(2)加入碎瓷片的作用是_____________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___________(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的__________(填“上口倒出”或“下口倒出”)。
(4)在环己烯粗产物蒸馏过程中,不可能用到的仪器有_______(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+ ![]() O2(g) →2CO2(g)+H2O(l) ;ΔH=-1 300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ;ΔH=-1 300 kJ·mol-1的说法中,正确的是( )
A.当5NA个电子转移时,该反应放出1 300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1 300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1 300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1 300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增加B,B的平衡转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Si的原子核外价电子排布图为___________________________
(2)金刚石的结构是正四面体则其中的碳原子杂化方式是_______________
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式____________________________;
②CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为__________;
③乙烯的分子是C2H4,是根据其结构推断是_________分子(填 “极性”或“非极性”)
(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度__________(填字母)
A.强 B.弱 C.相等 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按右图装置进行制取。

A B C D E
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____(填仪器名称);装置C的作用是_____________________。
(2)B中产生ClO2的化学方程式______________________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________________________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_________,检验该离子的方法是___________________________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________;
实验Ⅱ:样品杂质分析与纯度测定
(6)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________mol(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
A. ①④⑤⑥ B. ①③④⑥ C. ①②③⑤ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
![]()
I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:___________。检验反应后溶液中还存在Fe3+的试剂是__________。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是______,生成1molNa2FeO4转移电子数目为__________。
II.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是______;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是___________________。
(3)欲除去FeCl2中FeCl3选用合适的试剂和分离方法,并写出相应离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸(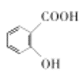 )是护肤品新宠儿。下列有关水杨酸的说法正确的是( )
)是护肤品新宠儿。下列有关水杨酸的说法正确的是( )
A.![]() 水杨酸最多可与
水杨酸最多可与![]() 发生加成反应
发生加成反应
B.与对甲氧基苯甲酸互为同系物
C.存在分子内氢键,使其在水中的溶解度减小
D.分子中的碳原子均采用![]() 杂化
杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com