
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+ ![]() O2(g) →2CO2(g)+H2O(l) ;ΔH=-1 300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ;ΔH=-1 300 kJ·mol-1的说法中,正确的是( )
A.当5NA个电子转移时,该反应放出1 300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1 300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1 300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1 300 kJ的能量
【答案】D
【解析】
A.热化学方程式中的化学计量数只表示物质的量,不表示微粒数,C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);△H=-1300kJ/mol,该反应中乙炔中-1价的碳经过反应变为产物二氧化碳中+4价的碳,所以每当放出1300kJ的能量,转移的电子数为10mol,当有5NA个电子转移时,放出的能量为650kJ,故A错误;
O2(g)=2CO2(g)+H2O(l);△H=-1300kJ/mol,该反应中乙炔中-1价的碳经过反应变为产物二氧化碳中+4价的碳,所以每当放出1300kJ的能量,转移的电子数为10mol,当有5NA个电子转移时,放出的能量为650kJ,故A错误;
B.该反应为放热反应,当1NA个水分子生成且为液体时,放出1300kJ的能量,故B错误;
C.1个CO2分子中含有4个共用电子对,有2NA个碳氧共用电子对生成时,说明有1molCO2生成,放出650kJ的能量,故C错误;
D.1个CO2分子中含有4个共用电子对,有8NA个碳氧共用电子对生成时,说明有2molCO2生成,放出1300kJ的能量,故D正确;
故答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度(t℃)下,向1 L密闭容器中通入H2和 I2各0.15 mol,发生如下反应: H2(g) + I2(g) ![]() 2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请回答:
(1)反应到第___________分钟达到平衡状态。
(2)2 min内,v(H2) =______________mol/(L·min)。
(3)下列能证明该反应已经达到平衡的是________(填字母)。
a. v正(H2)= v逆 (HI) b. 混合气体的颜色不再发生变化
c. 混合气体中各组分的物质的量不再发生变化 d. 混合气体的密度不再变化。
(4)①该反应的化学平衡常数表达式为_______________。②H2的平衡转化率是__________________。
(5)升高温度,化学平衡常数K要___________(填“变大”或“变小”)。
(6)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=______________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH===5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的个数之比为5∶1
C. Cl2既是氧化剂又是还原剂
D. 每生成1个氧化产物转移6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
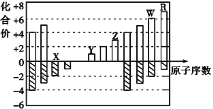
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1∶1和1∶2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l)=H2O(g);△H=+d kJmol-1
则△H1=____(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
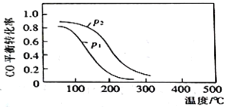
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2____(填“>”“<”或“ = ”)0。
②下列说法正确的是____(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=____mol L-1·min-1。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2mol CO、2mol H2、2mol CH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
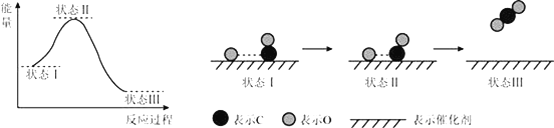
下列说法正确的是
A. CO和O生成CO2是吸热反应
B. 在该过程中,CO断键形成C和O
C. 同物质的量的CO和O反应比CO与O2反应放出更多热量
D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是______________。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是_________;只由极性共价键构成的物质是_____;由极性键和非极性键构成的物质是_______;由离子键和极性键构成的物质是_______。(填序号)。
(3)写出下列物质的电子式:CaF2:______________CO2:______________ NH4Cl:________________。
(4) 用电子式表示下列化合物的形成过程:H2S:__________________________________;MgCl2:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置的叙述正确的是( )
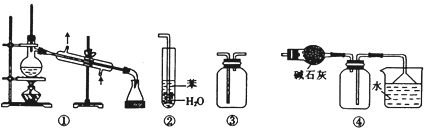
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②用于吸收NH3或HCl气体时,易形成倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3、C2H4等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 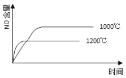
B. 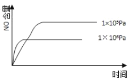
C. 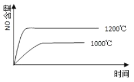
D. 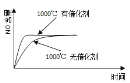
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com