
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是______________。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是_________;只由极性共价键构成的物质是_____;由极性键和非极性键构成的物质是_______;由离子键和极性键构成的物质是_______。(填序号)。
(3)写出下列物质的电子式:CaF2:______________CO2:______________ NH4Cl:________________。
(4) 用电子式表示下列化合物的形成过程:H2S:__________________________________;MgCl2:_____________________________。
【答案】![]() ⑤ ⑦ ④ ③⑥
⑤ ⑦ ④ ③⑥ ![]()
![]()

![]()
![]()
【解析】
(1)根据质子数与电子数的关系确定是否带电荷及电荷的多少、电性,根据质子数、中子数确定质量数;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答;
(3)CaF2中存在Ca2+和F-离子,通过离子键结合在一起;二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
(4)根据硫化氢中硫原子与氢原子之间通过共价键形成的共价化合物;氯化镁是氯离子和镁离子之间通过离子键形成的离子化合物。
(1)核中有17个质子,为Cl元素,有20个中子,质量数为17+20=37,核外有18个电子,核内质子数比核外电子数少1,所以该微粒是带一个单位负电荷,为阴离子,该粒子的化学符号是![]() ;
;
(2)①H2中只含非极性键;
②Na2O2中钠离子与过氧根离子之间存在离子键,存在O-O非极性键,属于离子化合物;
③NaOH中含有离子键和O-H极性键,属于离子化合物;
④H2O2中存在H-O极性键和O-O非极性键,属于共价化合物;
⑤CaCl2只存在离子键,属于离子化合物;
⑥NH4NO3中存在离子键和极性键,属于离子化合物;
⑦H2S中只存在极性共价键,为共价化合物;
则:只由离子键构成的物质是⑤;只由极性共价键构成的物质是⑦;由极性键和非极性键构成的物质是④;由离子键和极性键构成的物质是③⑥;
(3)CaF2中存在Ca2+和F-离子,电子式为![]() ;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:![]() ;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: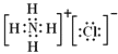 ;
;
(4)H2S的形成过程为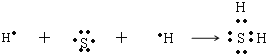 ,MgCl2的形成过程为
,MgCl2的形成过程为![]() 。
。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种紫黑色固体,只能在碱性环境中稳定存在,在中性或酸性中易分解,工业中通常是先制得高铁酸钠再转化为高铁酸钾。
I.制备NaCIO溶液
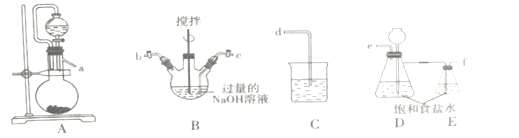
(1)装置的连接顺序为a→___→d。
(2)装置D的作用___。
(3)B装置反应过程中要严格控制温度,温度过高易生成NaClO3,写出生成NaClO3的离子方程式___。
II.制备K2FeO4
(1)湿法制备K2FeO4:将Fe(NO3)3溶液滴加到装置B的混合溶液中,其反应的离子方程式是___。继续向反应后的溶液中加入KOH,会析出紫黑色固体,上述转化能发生的原因是___(用简要的文字说明)。
(2)电解法制备K2FeO4(如图):

该装置中离子交换膜为___离子交换膜(填“阴”或“阳"),阳极电极反应式为___。
III.K2FeO4性质的探究
取电解后的溶液滴加稀盐酸,收集到黄绿色气体。针对以上现象,甲乙两位同学提出了以下猜想:
甲:气体只含有Cl2。
乙:气体除Cl2外还含有___,请设计实验证明乙同学的猜测___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。
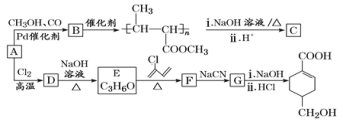
已知:![]() ;R—C
;R—C![]() N
N![]() R—COOH
R—COOH
完成下列填空:
(1)A的名称是__,A一定条件下与水加成,可以得到两种有机物,这两种有机物是__(填“同系物”或“同分异构体”或“同素异形体”)。
(2)C的结构简式为__,D→E的反应类型为__。
(3)E→F的化学方程式为__。
(4)B含有的官能团的名称是__(写名称)。B的同分异构很多,其中相同化学环境的氢原子有三种、比例为6:1:1且能发生银镜反应的是__(写结构简式,任写一种)。
(5)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)。__
合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+ ![]() O2(g) →2CO2(g)+H2O(l) ;ΔH=-1 300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ;ΔH=-1 300 kJ·mol-1的说法中,正确的是( )
A.当5NA个电子转移时,该反应放出1 300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1 300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1 300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1 300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
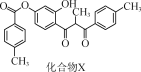
A.分子中所有碳原子共平面
B.分子中存在1个手性碳原子
C.化合物X不能使酸性KMnO4溶液褪色
D.1 mol化合物X最多可与12 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增加B,B的平衡转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Si的原子核外价电子排布图为___________________________
(2)金刚石的结构是正四面体则其中的碳原子杂化方式是_______________
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式____________________________;
②CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为__________;
③乙烯的分子是C2H4,是根据其结构推断是_________分子(填 “极性”或“非极性”)
(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度__________(填字母)
A.强 B.弱 C.相等 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
A. ①④⑤⑥ B. ①③④⑥ C. ①②③⑤ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32gNa2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况) 关系如图所示,下列说法中错误的是( )
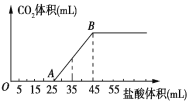
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B.A点溶液中的溶质为NaCl、NaHCO3
C.混合物中NaOH的质量0.60g
D.当加入35mL盐酸时,产生CO2的体积为224mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com